ملحوظة : فيما يلي وصف للنظريات العلمية حول سبب الصداع العنقودي. وهي مكتوبة باللغة التقنية العلمية.
موقع تطور الصداع العنقودي
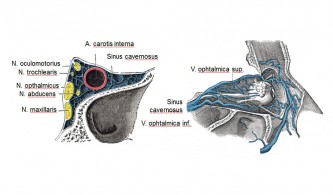
إحدى الخصائص الرئيسية للصداع العنقودي هو موقعه خلف عين واحدة وحولها . يمكن أن يحدث الصداع العنقودي أيضًا عند الأشخاص الذين إزالة مقلة عينهم من نفس الجانب من الصداع العنقودي. لا الألم يحدث داخل العين . لهذا السبب، من المحتمل أن ينشأ الصداع في هياكل حول العين أو خلفها . يمكن أن يحدث أيضًا في أمراض أعراض أخرى هذه الصور السريرية المحددة هي، على سبيل المثال، الأورام السحائية العنقية العلوية ، والأورام السحائية المجاورة للسرج ، والتشوهات الشريانية الوريدية الكبيرة في مجموعة واسعة من هياكل الدماغ المماثل ، والخراجات الغربالية في منطقة المنحدر وفي منطقة الصهاريج فوق السرج ، والغدة النخامية الأورام الغدية ، التكلسات في منطقة البطين الثالث، تمدد الأوعية الدموية في المماثل وتمدد الأوعية الدموية في الشريان المتصل الأمامي . كل هذه الهياكل تظهر علاقة بالخط الناصف في منطقة الجيب الكهفي . ولذلك فمن المعقول أن نفترض أن الجيب الكهفي هو البنية التشريحية ذات الصلة بشكل خاص بنشأة الصداع العنقودي.
تم إجراء فحوصات فنية مختلفة أثناء التقدم التلقائي عندما تم إجراء التصوير المقطعي بالرنين المغناطيسي أثناء نوبة الصداع العنقودي، تبين أن امتصاص زاد في منطقة الجيب الكهفي . يشير هذا إلى تغير التهابي في الجيب الكهفي أثناء نوبات الصداع العنقودي. ذلك ، أدلة على التغيرات الالتهابية السائل الدماغي الشوكي والدم المحيطي . عند إجراء تصوير الوريد، كان هناك دليل على وجود التهاب الأوعية الدموية الوريدية في منطقة الجيب الكهفي والوريد العيني العلوي خلال الفترة العنقودية. ومن المثير للاهتمام أن هذه يتم حلها تمامًا مرحلة المغفرة . ومن هذه الدراسات يمكن استنتاج أن منطقة التدفق الوريدي والجيب الكهفي لهما أهمية كبيرة في تطور آلام الصداع العنقودي.
إمداد الجهاز السمبتاوي عبر العصب الصخري العميق والفروع المدارية من العقدة الوتدية الحنكية والعقد العصبية الصغيرة الأخرى. تمر الألياف السمبتاوية عبر الشق فوق الحجاجي في منطقة الجيب الكهفي . الألياف الحسية التي تعصب الحجاج عن طريق العصب البصري ، كما أنها تمر جزئيًا عبر منطقة الجيب الكهفي . بعض الألياف تغذي الشريان القاعدي وتمتد جزئيًا مع العصب المبعد. كما يقوم العصب الصخري السطحي الأكبر بتزويد الشريان السباتي الداخلي بالألياف الحسية. الإمداد الحسي إلى الجيب الكهفي من ألياف العصب الثلاثي التوائم والعصب الوجهي . يتم تعصيب الأوردة الجافية والجيوب الجافوية ألياف مسببة العصب الخيمي . تشكل الألياف الحسية والودية والباراسمبثاوية ضفيرة في منطقة الجيب الكهفي . هناك مستقبلات ميكانيكية إضافية على طول الشريان السباتي الداخلي في القناة السباتية.
بسبب الهياكل التشريحية والنتائج المذكورة أعلاه، يمكن تحديد تطور الصداع العنقودي منطقة الجيب الكهفي عند تصوير الأوعية السباتية توسع الجيب الكهفي أو عرقلة مرور الوريد المداري خلال الفترة العنقودية في المنطقة المقابلة ظهرت التغييرات المقابلة، وخاصة توسع الجيب الكهفي، نفس جانب الصداع العنقودي الذي حدث. يمكن ملاحظة توسعات الأوعية الدموية أثناء الهجمات في منطقة الشريان العيني ، والشريان الدماغي الأمامي ، والشريان الدماغي الأوسط
كما تم تمدد الأوعية الدموية في منطقة الشريان العيني والشريان الدماغي الأمامي بين نوبات الصداع العنقودي . ونتيجة لهذه الحقيقة، لا يزال من غير الواضح ما إذا كانت توسعات الأوعية الدموية مرتبطة مباشرة بتطور الألم . وبغض النظر عن السببية، فإن التشابه يوفر دليلا على وجود صلة بين مراحل التوسع وحدوث الصداع.
الفحوصات الوريدية عن وجود التهاب وريدي في منطقة الوريد العيني العلوي وفي منطقة الجيب الكهفي خلال فترة الصداع العنقودي. نتائج مماثلة تحدث أيضًا في متلازمة تولوسا هانت ، حيث يُفترض وجود التهاب حبيبي في الهياكل المقابلة. علاج كلا المرضين العلاج المضاد للالتهابات باستخدام الكورتيكوستيرويدات من غير الواضح تمامًا سبب حدوث التهاب الجيب الكهفي والأوردة المحيطة خلال فترة الصداع العنقودي.
من الناحية الافتراضية ، يمكن افتراض أن ضيقة الشعب الهوائية الموصوفة في منطقة الأنف والأنف في المرضى الذين يعانون من الصداع العنقودية يمكن أن يؤدي إلى انخفاض مرور في تهوية الخلايا الإيثوية وأن العدوى المماثلة المقابلة. إنها فرضية محتملة لتكوين صداع الكتلة التهاب التهاب كهف الجيوب الأنفية المماثل على التوالي ومع ذلك ، لا يوجد أي دليل على هذا. يتم تعزيز هذه الاعتبارات من خلال الحدوث المتكرر للمدخنين. تظهر فترات الكتلة النشطة عادة في المواسم ذات القابلية المتكررة لعدوى الجهاز التنفسي العلوي.
التصوير العصبي والدراسات المورفومترية
يجب أن تأخذ الاعتبارات الفيزيولوجية المرضية لتطور الصداع العنقودي في الاعتبار توقيت البداية، والتكرار المؤقت للنوبات، وموقع الصداع، ومشاركة التنشيط الودي والباراسمبثاوي. في الأصل، تم تفسير تطور الصداع العنقودي من خلال التغيرات في أقطار الأوعية الدموية. وعلى هذا الأساس، يمكن أيضًا توضيح تأثير المواد المضيقة للأوعية والمؤثرات المسببة لتوسع الأوعية الدموية مثل النتروجليسرين والهيستامين.
يمكن استخدام التصوير المقطعي بالإصدار البوزيتروني (PET) لفحص التغيرات في تدفق الدم الدماغي الإقليمي. تتيح فحوصات التصوير المقطعي بالإصدار البوزيتروني (PET) عالية الدقة اكتشاف حتى التغيرات الصغيرة في تدفق الدم الدماغي الإقليمي أثناء الراحة وأثناء عمليات تنشيط معينة للدماغ. يمكن تحفيز نوبات الصداع العنقودي تجريبيًا بواسطة النتروجليسرين. لا تختلف هذه الهجمات المثارة تجريبيًا عن هجمات الصداع العنقودي التلقائية من حيث المعلمات الفيزيولوجية المرضية الأساسية. يمكن علاج الصداع العنقودي المثار تجريبيًا، مثل الصداع العنقودي التلقائي، بشكل فعال باستخدام السوماتريبتان.
الفريق العامل لماي وآخرون. (1998) وصف التنشيط الكبير في منطقة ما تحت المهاد المماثل أثناء الصداع العنقودي الحاد مقارنة بالفترة الخالية من الصداع في مجموعة من المرضى الذين يعانون من الصداع العنقودي.
- لم يتم العثور على أي تنشيط لجذع الدماغ لدى مرضى الصداع العنقودي، لذلك تم افتراض وجود تمايز عن عمليات جذع الدماغ الفيزيولوجية المرضية المحتملة كما هو الحال في الصداع النصفي.
- تدعم هذه النتائج أيضًا التجربة السريرية التي تفيد بأن المكونات النشطة المستخدمة لعلاج الصداع العنقودي ليست فعالة في الوقاية من الصداع النصفي، والعكس صحيح.
- يكشف تحفيز الألم التجريبي للجبهة باستخدام الكابسيسين عن أي تنشيط لجذع الدماغ أي تنشيط تحت المهاد من خلال تحفيز الألم التجريبي بالكابسيسين في منطقة الجبين.
- وبناءً على هذه النتائج، تم التوصل إلى أن تنشيط ما تحت المهاد هو عملية محددة للصداع العنقودي المرتبط بتحريض الألم أو الحفاظ عليه ولا يمثل استجابة ثانوية لتنشيط مستقبل الألم في منطقة الفرع الثلاثي التوائم الأول.
- ويقال إن منطقة ما تحت المهاد توضع في حالة من النشاط المتزايد خلال فترة الصداع العنقودي الحاد. من المفترض أن تعمل إيقاعات الساعة البيولوجية ودورات النوم والاستيقاظ على تنشيط المناطق الأساسية تحت المهاد باعتبارها "الحركات الأولية".
يفترض مفهوم الصداع الأولي حدوث تغييرات وظيفية كأساس للصداع. لا يُفترض وجود تغيرات هيكلية في الدماغ في حالات الصداع الأولية. ومع ذلك، باستخدام القياس المورفومتري القائم على فوكسل، تم وصف تغير هيكلي كبير في كثافة المادة الرمادية مقارنة بالضوابط الصحية. تم العثور على هذه التغييرات داخل فترة الكتلة النشطة وخارج فترة الكتلة النشطة. وتقع الاختلافات بشكل ثنائي في منطقة الدماغ البيني المتاخمة للبطين الثالث ومنقاري للقناة. تتوافق هذه المنطقة مع منطقة ما تحت المهاد الخلفي السفلي . لم يتم الكشف عن النتائج المقابلة في مرضى الصداع النصفي. أدى هذا إلى افتراض أن التغيرات الهيكلية قد تترافق مع عملية المرض في الصداع العنقودي، في حين تلعب الآليات الوظيفية البحتة دورا في الصداع النصفي.
بسبب نتائج التصوير من دراسات PET ودراسات الرنين المغناطيسي الوظيفي مع التحليلات المورفومترية المستندة إلى فوكسل ، والتغيرات الأوعية الدموية في الأوعية الدموية المباشرة من التركيز الأساسي للفيزيولوجيا المرضية للصداع الكتابي. تم افتراض التغييرات الوظيفية والهيكلية في الدماغ الأوسط وفي منطقة البونس للصداع النصفي ، في حين تم الاشتباه في التغييرات المقابلة في منطقة المادة الرمادية المهاد للصداع. بالإضافة إلى آليات التنشيط الوظيفية ، تتم مناقشة التغييرات الهيكلية في كثافة المادة الرمادية في منطقة ما تحت المهاد.
بناءً على هذه النتائج ، تم اقتراح تحفيز عميق في الدماغ لعلاج الصداع العنقودي. تم اختيار المنطقة المستهدفة لتحفيز الدماغ العميق بسبب الدراسات المورفومترية. تم تنفيذ التدخلات الأولى من قبل مجموعة العمل الإيطالية في Leone et al 2000. ومع ذلك ، فإن تحفيز الدماغ العمق في الصداع العنقودي لم يترك مرحلة العلاج التجريبي بسبب نتائج طويلة الإحباط على المدى الطويل وبسبب مخاطر كبيرة مع الوفاة (الزرع الناجم عن النزيف المميت). في دراسة مزدوجة من الدواء الوهمي فقط حتى الآن ، لا يمكن وصف فرق كبير بين التحفيز الحقيقي والتحفيز المزيف (Fontaine et al. 2010). كقاعدة عامة ، على الرغم من تحفيز الدماغ العميق ، فإن المزيد من الوقاية من المخدرات ضرورية. يتم الخلط بين الرعاية الطويلة المكثفة على المدى الطويل والأدوية والدورة التلقائية مع نتائج العلاج. يبرر الافتقار إلى الكفاءة العلاجية بشكل فردي مع أقطاب غير مصححة كجزء من تحفيز الدماغ العميق.
يبقى أن نرى ما إذا كانت التغيرات الهيكلية في منطقة ما تحت المهاد الخلفي السفلي مرتبطة بالألم بمعنى تنشيط غير محدد، أو نتيجة للعلاج السابق أو سبب للصداع. يظل استخدام التحفيز العميق للدماغ لعلاج الصداع العنقودي تجريبيًا، ولا نرى له مكانًا في الرعاية السريرية. يعتبر العمل الذي قام به ليون وآخرون في عام 2001 هو المثال الوحيد للتنفيذ العلاجي لنتائج التصوير، لكنه لم يثبت فعاليته. ومن وجهة نظرنا، فإن الدراسات لا تبرر الاستخدام السريري.
يجب ألا يؤدي تحفيز المناطق المستهدفة وتحسين الحدث إلى افتراض أن هذه المناطق هي سبب الفيزيولوجيا المرضية للصداع الكتلي. إن تحفيز الهياكل العصبية في الجهاز العصبي المركزي وفي الجهاز العصبي المحيطي يمكن أن يعدل العديد من آليات الألم وله تأثير غير محدد على الألم. هذا يتحدث أيضًا عن ذلك ، معدلات تحسين الصداع العنقودية ومتلازمات الألم الأخرى في تحفيز التخصص القذالي أو تحفيز العقد العقد. ex juvantibus بسبب نتائج التحفيز للإشارة إلى أن سبب الصداع العنقودية لا يبدو أنه مبرر بما فيه الكفاية في الوقت الحاضر. يظهر الدور الافتراضي للما تحت المهاد الخلفي السفلي في صداع الكتلة التوضيح المجاور (الاختصار: الببتيدات الجينية GCRP SPG Sphenopalatine Ganglion ، نواة اللعاب SSN vip vasoattinal alypeptides).
قامت الدراسات الحديثة بتحليل المسار طويل الأمد للصداع العنقودي وتغيرات المادة الرمادية. قام Nägel وآخرون في عام 2011 بفحص 75 مريضًا عنقوديًا (22 بشكل عرضي خلال الفترة النشطة، و35 بشكل عرضي خارج الفترة النشطة و18 مريضًا عنقوديًا مزمنًا) وقارنوا التغيرات في المادة الرمادية لدى 61 من أفراد المراقبة المتوازيين الأصحاء باستخدام القياس المورفولوجي القائم على فوكسل (VBM). أظهر المرضى الذين تعرضوا لنوبات عنقودية حادة مؤخرًا خلال فترة النشاط انخفاضًا أكثر وضوحًا في منطقة المادة الرمادية في نظام معالجة الألم المركزي. في مرضى الصداع العنقودي المزمن، تم الكشف عن تغييرات إضافية في منطقة الحزامية الأمامية واللوزة ومنطقة القشرة الحسية الجسدية الثانوية. خارج الفترة النشطة، لم تكن هناك تغييرات في المناطق المذكورة في المرضى الذين يعانون من الصداع العنقودي العرضي. لم تكن هناك تغييرات في منطقة ما تحت المهاد سواء في المجموعات الفرعية أو المجموعة الشاملة. توضح هذه البيانات فقدان المادة الرمادية في أنظمة معالجة الألم المركزية، خاصة في المرضى الذين يعانون من الصداع العنقودي المزمن. وفي المقابل، لا توجد تغييرات في منطقة ما تحت المهاد. النتائج مشابهة لتلك الخاصة بالمرضى الذين يعانون من اضطرابات الألم الأخرى. إنهم يدعمون الافتراض بأن التغيرات المورفولوجية هي آثار للألم الحاد وليست السبب الرئيسي. من الممكن أن تكون التغييرات مرتبطة بعمليات التأريخ. ويتجلى ذلك من خلال التشوهات الواضحة بشكل خاص في المرضى الذين يعانون من الصداع العنقودي المزمن. لم يتم اكتشاف التغيرات في منطقة ما تحت المهاد، وبالتالي فإن أهمية منطقة ما تحت المهاد في تطور الصداع العنقودي تظل مثيرة للجدل (Nägel et al. 2011; Holle and Obermann 2011).
التهاب في الجيب الكهفي
كشفت صور الوريد المداري التي تم إجراؤها لدى مرضى الصداع العنقودي خلال الفترات العنقودية النشطة عن أدلة على وجود عمليات التهابية في الجيب الكهفي ومنطقة الوريد العيني العلوي ذات أصل غير معروف. الألياف الحسية للعصب البصري، والألياف الودية التي تغذي الجفن والعين والوجه والمحجر والأوعية الوريدية الحجاجية، والأوعية الوريدية التي تستنزف الحجاج والوجه، مجمعة معًا في مساحة عظمية ضيقة في العين. منطقة الجيب الكهفي الشريان السباتي الداخلي (انظر الشكل التوضيحي). وبالتالي يمكن أن تؤثر العمليات الالتهابية المحلية على الألياف العصبية الحسية والمستقلة وكذلك الأوعية الوريدية والشريانية. يمكن تصور تهيج الألياف العصبية بشكل مباشر عن طريق الببتيدات العصبية الالتهابية ونتيجة للضغط الميكانيكي بواسطة الأوعية الالتهابية المتوسعة والمنتفخة. يمكن استخدام هذه النظرية لشرح الألم العنقودي والأعراض المختلفة المصاحبة له. تتوافق أيضًا قدرة المواد الموسعة للأوعية على إثارة هجمات عنقودية خلال الفترات العنقودية النشطة (الكحول، النتروجليسرين، الهستامين، نقص الأكسجة) والمواد المضيقة للأوعية (الأكسجين، السوماتريبتان، الإرغوتامين) على إنهائها بسرعة مع النموذج.
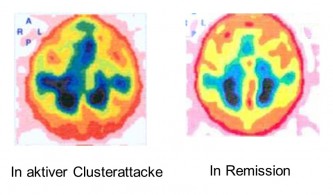
يُعتقد أن هناك رد فعل أساسي للالتهابات خلال فترات الكتلة النشطة التي تؤدي إلى تفاقم الهجمات. تم تنفيذ مخططات OA المدارية ، والتي اقترحت عملية التهابية ، بين هجومين خلال فترة الكتلة. في المرضى الذين يعانون من صداع الكتلة المزمن أو العرضي ، تم تنفيذ SPECT TC-99M الألبومين لمدة 10 دقائق ، 1 ساعة ، 3 ساعات و 6 ساعات بعد 600 ميجابت TC-99M المصل البشري (HSA). في مجموعة مراقبة صحية كان هناك توزيع غير متجانس للنشاط. في المقابل ، وجد مرضى الصداع العنقودي إثراء تتبع في منطقة كايفروس الجيوب الأنفية ، الجيوب الأنفية Sphenoparietalis ، V. opthalmica ، الجيوب الأنفية Petrosus و Sinus Sigmoideus (انظر التوضيح). يتوافق جانب صداع الكتلة والإخراج الإقليمي للبروتين مع جميع مرضى الصداع الكتلي. بعد العلاج الوقائي الفعال مع verapamil أو الكورتيكويدات ، اختفى تخصيب التتبع. وبالتالي ، ترتبط فترة الصداع النشط مع البروتين البلازما الإقليمي في سلم الدم الوريدي لقاعدة الدماغ كعلامة على التهاب الأوعية الدموية المحلية. العلاج الناجح مع Verapamil أو corticoids يمنع كل من التخلص من البلازما المماثل وهجمات الصداع العنقودية. هذا التفاعل الأساسي الالتهابي موجود بشكل مستمر في صداع الكتلة المزمن ، وفقط بشكل دوري في الشكل العرضي. إن الفعالية العالية والموثوقة للستيروئيدات القشرية المضادة للالتهابات للوقاية من الصداع العنقودية أمر مفهوم أيضًا. يتم عبور كهف الجيوب الأنفية بواسطة الشريان السباتي والأعصاب البصرية وأعصاب العين وعصب الوجه. تتأثر كل هذه الأعصاب أثناء هجوم الكتلة. مع هذه النظرية ، يمكن تفسير ألم الكتلة والآثار الجانبية المتنوعة. يمكن أن تنتهي القدرة على استفزاز مواد توسع الأوعية ، وهجمات المجموعة خلال فترات الكتلة النشطة (الكحول ، النتروجليسرين ، الهستامين ، نقص الأكسجة) والمواد المائية (الأكسجين ، السوماتريبتان ، الإرغوتامين) بسرعة مع النموذج.
يوضح الشكل المجاور دليلًا تشخيصيًا على تسرب البلازما من جانب واحد كتعبير عن التهاب الأوعية الدموية في الجيب الكهفي لدى مريض يعاني من فترة عنقودية نشطة. على جانب الهجمات العنقودية في الجيب الكهفي الأيمن والجيب الصخري العلوي، هناك علامات واضحة للالتهاب على شكل تسرب غير متماثل للبلازما من الأوردة في الزلال Tc-99m SPECT 10 دقائق، ساعة واحدة، 3 ساعات و بعد 6 ساعات من حقن 600 MBq Tc -99m من ألبومين المصل البشري (HSA). في حين أنه يمكن ملاحظة تناسق الجهاز الوعائي الوريدي في البداية بعد 10 دقائق، إلا أنه يتم العثور على عدم تناسق واضح بعد ثلاث ساعات بسبب زيادة تسرب البلازما. لم يتم العثور على هذه التغييرات في مرحلة مغفرة
إن تطور الألم هو أيضًا من النوم ، ويجلس المريض في وضعه في السرير أو الاستيقاظ ، ويكون محرك الأرق للمرضى مفهومًا: الصرف الوريدي لكهف الجيوب الأنفية يكون أسوأ عند الاستلقاء بسبب الظروف الهيدروستاتيكية أكثر من الجلوس أو أثناء الوقوف. لذلك يمكن افتراض أن هناك رد فعل أساسي التهابية خلال فترات الكتلة النشطة التي تؤدي إلى تفاقم الهجمات. من المفهوم أيضًا أن التدخين والانتقالات الموسمية ذات القابلية المتزايدة للالتهابات من أجل التهابات الجيوب الأنفية من المرجح أن تسير جنبًا إلى جنب مع حدوث فترات الكتلة النشطة.
تؤدي الأدوية المضادة للالتهابات مثل الكورتيزون إلى الإيقاف السريع للدورات العنقودية النشطة. ومع ذلك، فهي ليست مناسبة للعلاج على المدى الطويل بسبب آثارها الجانبية طويلة المدى. حاصرات قنوات الكالسيوم، مثل فيراباميل، تمنع التأثيرات الالتهابية لتسرب البلازما وهي مناسبة للعلاج على المدى الطويل. يمكن أن تكون مضادات الالتهاب غير الستيرويدية مثل الإندوميتاسين فعالة بشكل خاص في أشكال معينة من الصداع العنقودي، مثل نصف الجمجمة الانتيابي المزمن، ولكنها عادة لا تكون كافية للصداع العنقودي. وينطبق هذا أيضًا على الأسبرين والإيبوبروفين وما إلى ذلك. هذه الأدوية غير فعالة في النوبة الحادة، لكن الكثير من الناس يتناولونها ويعتقدون خطأً أن النوبات تهدأ بعد 2-3 ساعات بسبب هذه الأدوية. هناك أيضًا تقارير حالة فردية حول فعالية ماركومار في النوبات العنقودية؛ ربما يمنع هذا الدواء تراكم الصفائح الدموية في الجيب الكهفي من التكثيف بسبب التهاب الأوعية الدموية الوريدية. يمكن أن تعتمد فعالية الآزوثيوبرين في تقارير الحالات الفردية على انخفاض التفاعل الالتهابي الأساسي.
التغيرات العصبية
تقنيات فيزيولوجية كهربية مختلفة لتحليل التغيرات في نشاط الخلايا العصبية في الصداع العنقودي. إن التحليل في المقارنة الجانبية وكذلك التحليل خلال فترة الكتلة مقارنة بفترة المغفرة مناسب هنا أيضًا. الدليل على وجود اضطراب في المسارات الحسية من استخدام إمكانات جذع الدماغ المستثارة صوتيًا والإمكانات المستثارة الحسية الجسدية.
تم تفاعلات التلميذ . تعتبر Mioses واحدة من الخصائص الموجزة بشكل خاص لصداع الكتلة. تفاعل الضوء التوافقي بشكل أسرع وأكثر وضوحًا في مرضى الصداع الكتلي . هناك تصميم أسرع وأكبر على الضوء والبطيء والانخفاض في الظلام. يمكن الاعتقاد الخاطئ على الجانب المصاب بدرجة أقوى خلال هجوم عنقودي مقارنة بمرحلة مغفرة. تقليل تفاعل التلميذ على المحفزات الكهربائية المؤلمة للعصب السوراليس على الجانب المتأثر بالصداع العنقودي . قد يكون هذا التوسع في التلاميذ المنخفض بسبب زيادة نطاق من الببتيدات العصبية المنبعثة مثل المادة P و Neurokinine A ، والتي تؤدي إلى انقباض التلاميذ المباشر. إذا N. Infratrochlearis مباشرة كهربائيًا ، فهناك أيضًا انقباض تلميذ من جانب واحد لا يسببه آليات الكوليني. يمكن أيضًا نقل هذا التفاعل عن طريق إطلاق المادة P و neurokinin A. يمكن إطلاق هذه الخلايا العصبية بشكل متزايد أثناء هجوم الكتلة (P.OTEN) ، لأن التفاعل مع تحفيز الحلقات تحت العليا أقل بكثير . تشير هذه النتائج إلى أنه ليس فقط السكك الحديدية المحبوبة ، ولكن أيضًا الألياف الحسية للعصب التوائم في الفيزيولوجيا المرضية للصداع العنقودي يمكن أن تلعب دورًا مهمًا. كما أنه يتحدث عن تغيير في الخصائص الحسية التي يمكن ملاحظة زيادة حساسية الألم لمرضى الصداع الكتلي خلال فترة خالية من الصداع ، والتي يتم وضوحها بشكل خاص على الجانب المتأثر بالصداع الكتلي. يتم تطبيع حساسية الألم مرة أخرى خلال مرحلة مغفرة. فيما يتعلق بتفاعل متزايد لتحفيز الحفلات غير المقيدة ، يمكن تفسير مؤشر على زيادة استثارة الخلايا العصبية المميتة من العصب التوائم
هناك تغييرات أخرى في تفاعل التلميذ واضحة أيضًا في التحفيز الدوائي . تقطير الثنائية الثنائية لعلم الودي غير المباشر مثل هيدروكسي الأمهيتامين ، هناك انخفاض في داء الخلايا العصبي على الجانب المتأثر خلال مرحلة الكتلة النشطة خارج الهجوم. على العكس من ذلك ، عندما يكون الواطٍ المباشر ، مثل فينيليفرين على العين المتأثرة بالصداع الكتلي ، هو زيادة داء الفرق . من هذه النتائج ، وظيفة انخفاض في التعاطف على الجانب الأعراض . يتم تقليل تفاعل اللحام المستحث تجريبياً ، على سبيل المثال عند تطبيق الحرارة ، على الجانب الأعراض من المرضى المصابين خلال المرحلة النشطة في وقت خالي من الصداع. من خلال إدارة pilocarpin ، من ناحية أخرى ، يمكن ملاحظة تفاعل اللحام المتزايد على الجانب الأعراض. اعتبار هذه النتائج تعطيل الألياف المحببة بسبب انخفاض النشاط ، فرط الحساسية لمستقبلات ما بعد المشبكي. ذلك ، لا يجب بالضرورة أن يكون موقع الوظيفة المفرطة المحببة في المحيط ، يمكن أيضًا ملاحظة نتائج مماثلة في متلازمة هورنر المركزية