ملاحظة : تشرح التفسيرات التالية النظريات العلمية حول تطور الصداع العنقودي. وهي مكتوبة بمصطلحات علمية.
موقع منشأ الصداع العنقودي
من السمات الرئيسية للصداع العنقودي موقعه خلف العين وحولها . وقد يصيب هذا النوع من الصداع الأشخاص الذين لاستئصال مقلة العين في نفس جانب الصداع غير المرجح الألم عن العين نفسها . ولهذا السبب، يُحتمل أن يكون الصداع ناتجًا عن تراكيب حول العين أو خلفها . عند تحديد التراكيب التي تلعب دورًا حاسمًا في تطور الصداع العنقودي، من المهم ملاحظة أن هذا النوع من الصداع قد يحدث أيضًا في أمراض أخرى مصحوبة بأعراض . ومن أمثلة هذه الحالات السريرية المحددة: أورام السحايا العنقية العلوية ، وأورام السحايا التركي ، والتشوهات الشريانية الوريدية الكبيرة في مختلف تراكيب الدماغ على نفس الجانب ، والأكياس الغربالية في منطقة المنحدر والأحواض فوق السرجية ، وأورام الغدة النخامية ، والتكلسات في منطقة البطين الثالث، وتمدد الأوعية الدموية على نفس الجانب، وتمدد الشريان الأمامي الموصل . تُظهر جميع هذه البنى علاقةً بالخط المتوسط في منطقة الجيب الكهفي . ولذلك، من المعقول افتراض أن الجيب الكهفي هو البنية التشريحية ذات الصلة بشكل خاص بنشأة الصداع العنقودي.
خلال نوبة الصداع العنقودي التلقائية. أظهرت صور الرنين المغناطيسي التي أُجريت أثناء نوبة الصداع العنقودي زيادةً في تباين التباين في منطقة الجيب الكهفي ، مما يشير إلى عملية التهابية في الجيب الكهفي أثناء النوبة. علاوةً على ذلك، تم الكشف عن دلائل على تغيرات التهابية في السائل النخاعي والدم المحيطي خلال نوبة الصداع العنقودي . وكشف عن وجود الأوعية الدموية الوريدية في منطقة الجيب الكهفي والوريد العيني العلوي خلال فترة الصداع العنقودي. ومن المثير للاهتمام أن هذه النتائج غير الطبيعية اختفت تمامًا خلال فترة الهدوء . تشير هذه الدراسات إلى أن الجهاز الوريدي والجيب الكهفي يلعبان دورًا هامًا في تطور ألم الصداع العنقودي.
الجهاز العصبي اللاودي العصب الصخري العميق والفروع المدارية من العقدة الوتدية الحنكية ، بالإضافة إلى عقد عصبية دقيقة أخرى. تمر الألياف اللاودية عبر الشق فوق الحجاجي في منطقة الجيب الكهفي . أما الألياف الحسية التي تُغذي الحجاج، فيُغذّيها العصب العيني ، وتمر جزئيًا أيضًا عبر منطقة الجيب الكهفي . تُغذّي بعض هذه الألياف الشريان القاعدي، ولذلك، تسير بمحاذاة العصب المُبعد لجزء من مسارها. كما يُغذّي العصب الصخري السطحي الكبير الشريان السباتي الباطن بألياف حسية. الجيب الكهفي ألياف من العصبين الثلاثي التوائم والوجهي . أما الأوردة والجيوب الجافية ، فتُغذّيها ألياف حسية من العصب الخيمي . تشكل الألياف الحسية والودية واللاودية ضفيرة في منطقة الجيب الكهفي . وتوجد مستقبلات ميكانيكية إضافية على طول مسار الشريان السباتي الداخلي في القناة السباتية.
يمكن تحديد منشأ الصداع العنقودي في الجيب الكهفي بناءً على البنية التشريحية والنتائج المذكورة سابقًا يُظهر تصوير الأوعية السباتية توسعًا ، أو انسدادًا في مساره عند تصوير الأوردة المدارية خلال نوبات الصداع العنقودي. تُلاحظ هذه التغيرات، وخاصة توسع الجيب الكهفي، على نفس جانب الصداع العنقودي. بالإضافة إلى ذلك، يمكن ملاحظة توسعات وعائية أثناء النوبات في الشريان العيني ، والشريان الدماغي الأمامي ، والشريان الدماغي الأوسط
لوحظ توسع الأوعية الدموية في العيني والشريان الدماغي الأمامي بين نوبات الصداع العنقودي . ولهذا السبب، لا يزال من غير الواضح ما إذا كان توسع الأوعية الدموية مرتبطًا بشكل مباشر بظهور الألم . ومع ذلك، وبغض النظر عن السببية، فإن طبيعة التوسع في نفس جانب الرأس تشير إلى وجود صلة بين مراحل التوسع ونوبات الصداع.
تكشف فحوصات تصوير الأوردة التهاب وريدي في منطقة الوريد العيني العلوي والجيب الكهفي أن نتائج مماثلة تُلاحظ أيضًا في متلازمة تولوزا-هانت ، حيث يُفترض وجود التهاب حبيبي في البنى المقابلة. ويمكن علاج كلتا الحالتين بفعالية عالية باستخدام العلاج بالكورتيكوستيرويدات المضادة للالتهاب . ولا يزال سبب حدوث التهاب الجيب الكهفي والأوردة المحيطة به أثناء نوبة الصداع العنقودي غير واضح تمامًا.
من الناحية النظرية ، يُمكن افتراض أن تضيّق المسالك الهوائية في منطقة الأنف والجيوب الأنفية، الذي يُوصف غالبًا لدى مرضى الصداع العنقودي، قد يُؤدي إلى ضعف تهوية الخلايا الغربالية ، مما يُعزز حدوث عدوى في نفس الجانب. انتشار الالتهاب لاحقًا إلى الجيب الكهفي في نفس الجانب فرضيةً مُحتملةً لتفسير آلية حدوث الصداع العنقودي. مع ذلك، لا يوجد حاليًا أي دليل يدعم هذه الفرضية. وتتعزز هذه الاعتبارات بزيادة انتشار الصداع العنقودي بين المدخنين. علاوةً على ذلك، تحدث نوبات الصداع العنقودي النشطة عادةً خلال فصول السنة التي يزداد فيها احتمال الإصابة بعدوى الجهاز التنفسي العلوي.
دراسات التصوير العصبي والدراسات المورفومترية
يجب أن تأخذ الاعتبارات الفيزيولوجية المرضية المتعلقة بتطور الصداع العنقودي في الحسبان توقيت بدء النوبات، وتجمعها المؤقت، وموقعها، ودور تنشيط الجهاز العصبي الودي واللاودي. في الأصل، فُسِّر تطور الصداع العنقودي بتغيرات في قطر الأوعية الدموية. وقد ساعد هذا أيضًا في توضيح تأثيرات المواد المُضيِّقة للأوعية الدموية، وتحفيزها بواسطة موسعات الأوعية الدموية مثل النيتروجليسرين والهيستامين.
يمكن استخدام التصوير المقطعي بالإصدار البوزيتروني (PET) لدراسة التغيرات في تدفق الدم الدماغي الإقليمي. تسمح فحوصات PET عالية الدقة برصد حتى أدق التغيرات في تدفق الدم الدماغي الإقليمي في حالة الراحة وأثناء بعض عمليات تنشيط الدماغ. يمكن إحداث نوبات الصداع العنقودي تجريبياً باستخدام النيتروجليسرين. لا تختلف هذه النوبات المُحدثة تجريبياً عن نوبات الصداع العنقودي التلقائية من حيث المعايير الفيزيولوجية المرضية الأساسية. يمكن علاج الصداع العنقودي المُحدث تجريبياً، مثل الصداع العنقودي التلقائي، بفعالية باستخدام السوماتريبتان.
وصفت مجموعة البحث التابعة لماي وآخرون (1998) تنشيطًا كبيرًا في منطقة ما تحت المهاد على نفس الجانب أثناء الصداع العنقودي الحاد في مجموعة من المرضى الذين يعانون من الصداع العنقودي، مقارنة بفترة خالية من الصداع.
- لم يتم العثور على أي تنشيط لجذع الدماغ لدى مرضى الصداع العنقودي، لذلك تم افتراض وجود فرق عن العمليات الفيزيولوجية المرضية المحتملة لجذع الدماغ كما هو الحال في الصداع النصفي.
- وتؤكد هذه النتائج أيضاً الخبرة السريرية التي تفيد بأن الأدوية المستخدمة لعلاج الصداع العنقودي ليست فعالة في منع الصداع النصفي، والعكس صحيح.
- لم تنشيط لجذع الدماغ أثناء التحفيز التجريبي للألم في الجبهة باستخدام الكابسيسين ، كما لم أي تنشيط في منطقة ما تحت المهاد من خلال التحفيز التجريبي للألم باستخدام الكابسيسين في منطقة الجبهة.
- وبناءً على هذه النتائج، تم استنتاج أن تنشيط منطقة ما تحت المهاد هو عملية محددة للصداع العنقودي، ويرتبط ببدء الألم أو استمراره، وليس استجابة ثانوية لتنشيط مستقبلات الألم في منطقة الفرع الثلاثي التوائم الأول.
- يُفترض أن يصل الوطاء إلى حالة من التنشيط المتزايد خلال فترة الصداع العنقودي الحاد. وتهدف الإيقاعات اليومية ودورات النوم والاستيقاظ إلى تنشيط نوى الوطاء باعتبارها القوة الدافعة الرئيسية.
يفترض مفهوم الصداع الأولي أن التغيرات الوظيفية هي السبب الكامن وراء الصداع. ولا يُفترض وجود تغيرات بنيوية في الدماغ في حالات الصداع الأولي. مع ذلك، وباستخدام قياس التشكل المعتمد على الفوكسل، وُصف تغير بنيوي ملحوظ في كثافة المادة الرمادية مقارنةً بالأفراد الأصحاء. وقد لوحظت هذه التغيرات أثناء فترة النوبات العنقودية النشطة وخارجها. وتركزت الاختلافات ثنائياً في منطقة الدماغ البيني المجاورة للبطين الثالث وأمام قناة سيلفيوس. وتتطابق هذه المنطقة مع منطقة الوطاء الخلفي السفلي . ولم تُلاحظ نتائج مماثلة لدى مرضى الشقيقة. وقد أدى ذلك إلى فرضية مفادها أن التغيرات البنيوية قد تكون مرتبطة بمسار المرض في الصداع العنقودي، بينما تلعب الآليات الوظيفية البحتة دوراً في الشقيقة.
استنادًا إلى نتائج التصوير المقطعي بالإصدار البوزيتروني (PET) والتصوير بالرنين المغناطيسي الوظيفي (fMRI) مع التحليلات المورفومترية القائمة على وحدات البكسل، فقد تراجع التركيز الأساسي لآلية حدوث الصداع العنقودي على التغيرات الوعائية المباشرة، سواءً كانت مُضيِّقة أو مُوسِّعة. وقد تم افتراض حدوث تغيرات وظيفية وبنيوية في الدماغ المتوسط والجسر في الشقيقة، بينما يُشتبه في حدوث تغيرات مماثلة في المادة الرمادية في منطقة ما تحت المهاد في الصداع العنقودي. وبالإضافة إلى آليات التنشيط الوظيفي، يجري أيضًا مناقشة التغيرات البنيوية في كثافة المادة الرمادية في منطقة ما تحت المهاد.
استنادًا إلى هذه النتائج، اقتُرح التحفيز العميق للدماغ (DBS) لعلاج الصداع العنقودي. تم اختيار المنطقة المستهدفة للتحفيز العميق للدماغ بناءً على دراسات مورفومترية. أجرى فريق البحث الإيطالي بقيادة ليون وآخرون أولى العمليات في عام 2000. مع ذلك، ونظرًا للنتائج المخيبة للآمال على المدى الطويل والمخاطر الجسيمة، بما في ذلك المخاطر المميتة (النزيف الدماغي المميت الناجم عن الزرع)، ظل التحفيز العميق للدماغ لعلاج الصداع العنقودي علاجًا تجريبيًا وتم التخلي عنه إلى حد كبير. لم تجد الدراسة الوحيدة التي خضعت للتحكم الوهمي والمزدوجة التعمية حتى الآن أي فرق يُعتد به إحصائيًا بين التحفيز الفعلي والوهمي (فونتين وآخرون، 2010). وكقاعدة عامة، يلزم تناول أدوية وقائية إضافية رغم استخدام التحفيز العميق للدماغ. تتداخل عوامل عديدة مع نتائج العلاج، منها المراقبة المكثفة طويلة الأمد، وتعديل الأدوية، والمسار الطبيعي للحالة. يُعزى عدم كفاية فعالية العلاج أحيانًا إلى وضع الأقطاب الكهربائية بشكل غير صحيح أثناء التحفيز العميق للدماغ.
لا يزال من غير الواضح ما إذا كانت التغيرات البنيوية في منطقة ما تحت المهاد السفلية الخلفية مرتبطة بالألم بمعنى التنشيط غير المحدد، أو أنها نتيجة لعلاج سابق، أو أنها سبب الصداع. ولا يزال استخدام التحفيز العميق للدماغ لعلاج الصداع العنقودي تجريبيًا، ولا نرى له مكانًا في الرعاية السريرية. وتُعتبر دراسة ليون وآخرون (2001) المثال الوحيد على التطبيق العلاجي لنتائج التصوير، لكنها لم تثبت فعاليتها. وفي رأينا، لم تُبرر هذه الدراسات استخدامها سريريًا.
لا ينبغي أن يؤدي تحفيز المناطق المستهدفة والتحسن العرضي إلى افتراض أن هذه المناطق هي السبب الرئيسي في الفيزيولوجيا المرضية للصداع العنقودي. إذ يمكن لتحفيز البنى العصبية في كل من الجهاز العصبي المركزي والمحيطي أن يُعدّل العديد من آليات الألم، وله تأثير غير محدد على عملية الألم. ويدعم ذلك أيضًا معدلات تحسن الصداع العنقودي ومتلازمات الألم الأخرى بعد تحفيز العصب القذالي الكبير أو العقدة الوتدية. ولا يبدو أن استخلاص استنتاجات حول سبب الصداع العنقودي بناءً على نتائج التحفيز وحدها مُبرر بشكل كافٍ في الوقت الراهن. ويُبين الشكل المجاور الدور الافتراضي للوطاء الخلفي السفلي في الصداع العنقودي (الاختصارات: GCRP الببتيد المرتبط بجين الكالسيتونين، SPG: العقدة الوتدية الحنكية، SSN: النواة اللعابية العلوية، VIP: الببتيد المعوي الفعال وعائياً).
حللت دراسات حديثة المسار طويل الأمد للصداع العنقودي والتغيرات في المادة الرمادية. فحص ناغل وآخرون (2011) 75 مريضًا بالصداع العنقودي (22 منهم يعانون من نوبات متقطعة خلال الفترة النشطة، و35 يعانون من نوبات متقطعة خارج الفترة النشطة، و18 يعانون من الصداع العنقودي المزمن) وقارنوا تغيرات المادة الرمادية لدى 61 شخصًا سليمًا من نفس الفئة العمرية والجنس باستخدام قياس التشكل المعتمد على الفوكسل (VBM). أظهر المرضى الذين عانوا من نوبات حادة حديثة من الصداع العنقودي خلال الفترة النشطة انخفاضًا ملحوظًا في المادة الرمادية ضمن نظام معالجة الألم المركزي. لدى مرضى الصداع العنقودي المزمن، تم رصد تغيرات إضافية في القشرة الحزامية الأمامية، واللوزة الدماغية، والقشرة الحسية الجسدية الثانوية. خارج الفترة النشطة، لم تُلاحظ أي تغيرات في هذه المناطق لدى مرضى الصداع العنقودي المتقطع. لم تُلاحظ أي تغيرات في منطقة ما تحت المهاد في أي من المجموعات الفرعية أو المجموعة ككل. تُظهر هذه البيانات فقدانًا للمادة الرمادية في أنظمة معالجة الألم المركزية، وخاصة لدى مرضى الصداع العنقودي المزمن. في المقابل، لم تُلاحظ أي تغييرات في منطقة ما تحت المهاد. تتشابه هذه النتائج مع نتائج مرضى يعانون من اضطرابات ألم أخرى، وتدعم فرضية أن التغيرات المورفولوجية هي آثار للألم الحاد وليست السبب الرئيسي. قد تكون هذه التغيرات مرتبطة بعمليات المزمنة، وهو ما تدعمه التشوهات الواضحة بشكل خاص لدى مرضى الصداع العنقودي المزمن. لم تُكتشف أي تغييرات في منطقة ما تحت المهاد، لذا يبقى دورها في تطور الصداع العنقودي محل جدل (ناجل وآخرون، 2011؛ هول وأوبرمان، 2011).
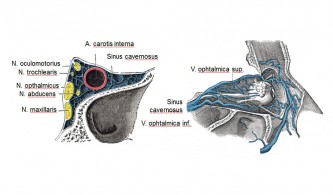
التهاب في الجيب الكهفي
أظهرت صور الأوردة المدارية التي أُجريت لمرضى الصداع العنقودي خلال فترات نشاطه وجودَ عمليات التهابية في الجيب الكهفي والوريد العيني العلوي، ذات منشأ غير واضح. داخل الجيب الكهفي، تتجمع الألياف الحسية للعصب العيني، والألياف الودية التي تغذي الجفن والعين والوجه والحجاج والأوعية خلف الحجاج في نفس الجانب، والأوعية الوريدية التي تصرف الدم من الحجاج والوجه، والشريان السباتي الباطني، في حيز عظمي ضيق للغاية (انظر الشكل). وبالتالي، يمكن أن تؤثر العمليات الالتهابية الموضعية على كلٍّ من الألياف العصبية الحسية واللاإرادية، بالإضافة إلى الأوعية الوريدية والشريانية. من الممكن حدوث تهيج للألياف العصبية بشكل مباشر بواسطة الببتيدات العصبية الالتهابية، وكنتيجة للضغط الميكانيكي الناتج عن الأوعية الملتهبة والمتورمة. يمكن لهذه النظرية أن تفسر ألم الصداع العنقودي وأعراضه المصاحبة المتنوعة. إن قدرة المواد الموسعة للأوعية الدموية على إثارة نوبات التكتل أثناء فترات التكتل النشطة (الكحول، النيتروجليسرين، الهيستامين، نقص الأكسجة) وقدرة المواد المضيقة للأوعية الدموية (الأكسجين، السوماتريبتان، الإرغوتامين) على إنهائها بسرعة تتوافق أيضًا مع النموذج.
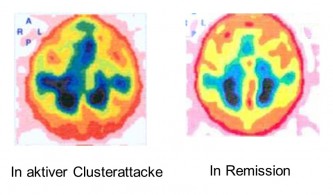
يُفترض وجود استجابة التهابية أساسية خلال فترات نشاط الصداع العنقودي، والتي تتفاقم أثناء النوبات. أُجريت فحوصات تصوير الأوردة المدارية، التي أشارت إلى وجود عملية التهابية، بين النوبات خلال فترة الصداع العنقودي. في المرضى الذين يعانون من الصداع العنقودي المزمن أو العرضي، أُجري تصوير مقطعي محوسب بانبعاث الفوتون المفرد (SPECT) باستخدام ألبومين Tc-99m بعد 10 دقائق، وساعة واحدة، و3 ساعات، و6 ساعات من حقن 600 ميغابيكريل من ألبومين مصل الدم البشري (HSA) الموسوم بـ Tc-99m خلال فترة نشاط الصداع العنقودي. في مجموعة التحكم السليمة، وُجد توزيع غير متجانس للنشاط الإشعاعي. في المقابل، في مرضى الصداع العنقودي، وُجد تراكم للمادة المشعة في منطقة الجيب الكهفي، والجيب الوتدي الجداري، والوريد العيني، والجيب الصخري، والجيب السيني خلال المرحلة النشطة (انظر الشكل). تطابق جانب الصداع العنقودي مع منطقة تسرب البروتين في جميع مرضى الصداع العنقودي. بعد العلاج الوقائي الفعال باستخدام فيراباميل أو الكورتيكوستيرويدات، اختفى ازدياد امتصاص المادة المشعة. وبالتالي، ترتبط فترة الصداع العنقودي النشط بتسرب بروتينات البلازما الموضعي في الجيوب الوريدية في قاعدة الدماغ كعلامة على التهاب الأوعية الدموية الموضعي. ويؤدي العلاج الناجح باستخدام فيراباميل أو الكورتيكوستيرويدات إلى منع كل من تسرب البلازما في نفس جانب الصداع ونوبات الصداع العنقودي. في الصداع العنقودي المزمن، يكون هذا التفاعل الالتهابي الكامن موجودًا باستمرار، بينما يكون دوريًا فقط في شكله العرضي. وهذا يفسر أيضًا الفعالية العالية والموثوقة للكورتيكوستيرويدات المضادة للالتهاب في الوقاية من الصداع العنقودي. يمر الشريان السباتي والأعصاب البصرية والأعصاب العينية والعصب الوجهي عبر الجيب الكهفي. وتتأثر جميع هذه الأعصاب أثناء نوبة الصداع العنقودي. وتفسر هذه النظرية ألم الصداع العنقودي وأعراضه المصاحبة المتنوعة. إن قدرة المواد الموسعة للأوعية الدموية على إثارة نوبات التكتل أثناء فترات التكتل النشطة (الكحول، النيتروجليسرين، الهيستامين، نقص الأكسجة) وقدرة المواد المضيقة للأوعية الدموية (الأكسجين، السوماتريبتان، الإرغوتامين) على إنهائها بسرعة تتوافق أيضًا مع النموذج.
تُظهر الصورة المجاورة الدليل التشخيصي لتسرب البلازما أحادي الجانب كدليل على التهاب الأوعية الدموية في الجيب الكهفي لدى مريض يعاني من نوبة عنقودية نشطة. في جانب النوبات العنقودية في الجيب الكهفي الأيمن والجيب الصخري العلوي، تظهر علامات واضحة للالتهاب على شكل تسرب بلازما غير متناظر من الأوردة في فحوصات التصوير المقطعي المحوسب بانبعاث الفوتون المفرد (SPECT) باستخدام ألبومين Tc-99m بعد 10 دقائق، وساعة واحدة، و3 ساعات، و6 ساعات من حقن 600 ميغابيكريل من ألبومين مصل الدم البشري (HSA) الموسوم بـ Tc-99m. بينما لوحظ تناظر أولي في الجهاز الوعائي الوريدي بعد 10 دقائق، ظهر عدم تناظر واضح بعد ثلاث ساعات نتيجةً لزيادة تسرب البلازما بمرور الوقت. لم تُلاحظ هذه التغيرات خلال فترة الهدوء
يُصبح بدء الألم أثناء النوم، وبقاء المريض جالسًا في السرير أو نهوضه، وحركته المضطربة، أمورًا مفهومة: إذ يكون تصريف الدم الوريدي من الجيب الكهفي أقل كفاءة عند الاستلقاء بسبب ضغط السوائل مقارنةً بالجلوس أو الوقوف. لذا، يُمكن افتراض وجود استجابة التهابية كامنة خلال فترات النوبات المتكررة، والتي تتفاقم مع ازدياد حدة النوبات. وهذا يُفسر أيضًا سبب ارتباط التدخين والتغيرات الموسمية، وما يصاحبها من زيادة في قابلية الإصابة بالتهابات الجيوب الأنفية، بارتفاع احتمالية حدوث نوبات متكررة.
تؤدي الأدوية المضادة للالتهاب، مثل الكورتيزون، إلى توقف سريع لنوبات الصداع العنقودي النشطة. مع ذلك، ونظرًا لآثارها الجانبية طويلة الأمد، فهي غير مناسبة للعلاج طويل الأمد. أما حاصرات قنوات الكالسيوم، مثل فيراباميل، فتمنع التأثيرات الالتهابية عن طريق منع تسرب البلازما، وهي مناسبة للعلاج طويل الأمد. قد تكون مضادات الالتهاب غير الستيرويدية، مثل الإندوميثاسين، فعالة بشكل خاص في أنواع معينة من الصداع العنقودي، مثل الصداع النصفي الانتيابي المزمن، ولكنها عادةً ما تكون غير كافية لعلاج الصداع العنقودي. وينطبق هذا أيضًا على الأسبرين والإيبوبروفين، وغيرها. هذه الأدوية غير فعالة أثناء النوبة الحادة، ومع ذلك يتناولها الكثيرون معتقدين خطأً أن انحسار النوبات بعد ساعتين إلى ثلاث ساعات يعود إلى هذه الأدوية. كما توجد تقارير حالات عن فعالية الوارفارين (الكومادين) في نوبات الصداع العنقودي؛ إذ يُرجح أن هذا الدواء يمنع تفاقم تراكم الصفائح الدموية في الجيب الكهفي الناتج عن التهاب الأوعية الدموية الوريدية. قد تستند فعالية دواء أزوثيوبرين في التقارير السريرية إلى تقليل الاستجابة الالتهابية الكامنة.
التغيرات العصبية
طرقٌ كهروفيزيولوجيةٌ متنوعةٌ لتحليل التغيرات في النشاط العصبي أثناء نوبات الصداع العنقودي. وهنا أيضًا، يُعدّ التحليل المقارن، وتحليل فترة النوبة مقارنةً بفترة الهدوء، مفيدًا. ويمكن الحصول على أدلةٍ على اضطراب المسارات الحسية من خلال استخدام كمونات جذع الدماغ السمعية وكمونات الحس الجسدي المستحثة.
استجابات الحدقة لدى مرضى الصداع العنقودي بتفصيل دقيق تضيّق الحدقة أحد أبرز سمات الصداع العنقودي. ويُلاحظ رد فعل الحدقة الضوئي التوافقي بشكل أسرع وأكثر وضوحًا لدى هؤلاء المرضى الخلل في الجانب المصاب مقارنةً بفترة الهدوء. وتكون استجابة الحدقة للمنبهات الكهربائية المؤلمة للعصب الربلي أقل في الجانب المصاب بالصداع العنقودي . وقد يكون سبب هذا الانخفاض في توسع الحدقة هو زيادة إفراز الببتيدات العصبية ، مثل المادة P والنيوروكينين A، مما يؤدي إلى انقباض مباشر للحدقة. كما يؤدي للعصب تحت البكرة انقباض أحادي الجانب للحدقة ، وهو انقباض لا يتوسطه آليات كولينية. يمكن أن تتوسط هذه الاستجابة أيضًا إفراز المادة P والنيوروكينين A. قد تُفرز هذه الببتيدات العصبية بكميات متزايدة أثناء نوبات الصداع العنقودي (انظر أعلاه)، حيث الاستجابة لتحفيز العصب تحت البكرة أضعف بكثير . تشير هذه النتائج إلى أن المسارات الودية، بالإضافة إلى الألياف الحسية للعصب ثلاثي التوائم ، قد تلعب دورًا هامًا في الفيزيولوجيا المرضية للصداع العنقودي. ومن الأدلة الأخرى على تغير الخصائص الحسية زيادة حساسية الألم التي تُلاحظ لدى مرضى الصداع العنقودي خلال فترات الراحة، والتي تبرز بشكل خاص في الجانب المصاب بالصداع. خلال فترة الهدوء، تعود حساسية الألم إلى طبيعتها. بالاقتران مع زيادة الاستجابة لتحفيز العصب تحت البكرة، يمكن تفسير مؤشر على زيادة استثارة الخلايا العصبية الحسية للألم في العصب ثلاثي التوائم
تُلاحَظ تغيرات إضافية في استجابة الحدقة مع التحفيز الدوائي يؤدي التقطير الثنائي لمُحاكيات الجهاز العصبي الودي غير المباشرة ، مثل هيدروكسي أمفيتامين، انخفاض توسع الحدقة في الجانب المصاب خلال المرحلة النشطة من النوبة خارج وقتها. في المقابل، يؤدي إعطاء مُحاكي للجهاز العصبي الودي المباشر ، مثل فينيليفرين، للعين المصابة بالصداع العنقودي إلى زيادة توسع الحدقة . تشير هذه النتائج إلى انخفاض وظيفة الجهاز العصبي الودي في الجانب المصاب . كما يقل التعرق المُستحث تجريبيًا، على سبيل المثال، بتطبيق الحرارة، في الجانب المصاب لدى المرضى خلال المرحلة النشطة في فترات خلوهم من الصداع. في المقابل، يؤدي إعطاء بيلوكاربين إلى زيادة التعرق في الجانب المصاب. يمكن أيضًا تفسير هذه النتائج كدليل على خلل في وظيفة الألياف الودية فرط حساسية المستقبلات بعد المشبكية. ومع ذلك، فإن موضع فرط النشاط الودي ليس بالضرورة محيطيًا ، يمكن ملاحظة نتائج مماثلة في متلازمة هورنر المركزية .