يُعدّ الصداع النصفي من أكثر الأمراض المُنهكة التي عرفها الإنسان. ووفقًا لتقرير حديث صادر عن منظمة الصحة العالمية، يحتل الصداع النصفي المرتبة السادسة بين أكثر الأمراض المُسببة للعجز. وإذا ما أُضيف إليه الصداع الناتج عن الإفراط في استخدام الأدوية، يحتل الصداع النصفي المرتبة الثالثة. وبالنظر إلى الأشكال المختلفة للصداع البالغ عددها 367 نوعًا والمعروفة حاليًا، يُعتبر الصداع النصفي والصداع عمومًا من أشدّ الأمراض وأكثرها شيوعًا وإعاقةً لدى البشر.
تشمل خيارات العلاج الدوائي الحالية للصداع النصفي العلاجات الوقائية وعلاج نوبات الصداع الحادة. ولا يحصل جزء كبير من المصابين على راحة كافية من خلال العلاجات الوقائية. وحتى العلاجات الحالية للنوبات، بخياراتها المتاحة، قد لا توفر راحة فعالة، وقد توجد موانع استخدام أو عدم تحمل.
أظهرت دراسات حديثة أدلة وافرة على أن الببتيد المرتبط بجين الكالسيتونين، أو CGRP اختصارًا، يلعب دورًا هامًا في تطور الصداع النصفي واستمراره وتحوله إلى حالة مزمنة. CGRP هو ببتيد عصبي يتكون من 37 حمضًا أمينيًا، ويتم ترميزه بواسطة نفس الجين الذي يُشفّر هرمون الكالسيتونين.
لذا، أصبح الببتيد المرتبط بجين الكالسيتونين (CGRP) محورًا لخيارات علاجية جديدة للصداع النصفي. ويمثل تطوير مضادات مستقبلات CGRP، المعروفة باسم الجيبانتات، فئة جديدة من الأدوية لعلاج الحادة . إلا أن تطويرها توقف بسبب سميتها الكبدية.
يركز البحث الحالي بشكل مكثف على تطوير الأجسام المضادة وحيدة النسيلة ضد الببتيد المرتبط بجين الكالسيتونين (CGRP). تلعب الآليات الوعائية والعصبية دورًا في الفيزيولوجيا المرضية المعقدة للصداع النصفي. تشمل النواقل العصبية الرئيسية المشاركة في تطور ألم الصداع النصفي السيروتونين (5-هيدروكسي تريبتامين، 5-HT)، وأكسيد النيتريك، وCGRP. يتكون CGRP من 37 حمضًا أمينيًا، وقد اكتُشف منذ حوالي 30 عامًا. وهو منتشر على نطاق واسع في جميع أنحاء الجهاز العصبي المركزي والمحيطي. يتم تعصيب كل عضو رئيسي بألياف عصبية تحتوي على CGRP. على وجه الخصوص، يوجد CGRP ومستقبلاته في تراكيب تشريحية مهمة لتطور الصداع النصفي، بما في ذلك القشرة الدماغية، والسحايا، والوطاء، والمخيخ، وجذع الدماغ. كما يوجد CGRP في العديد من الخلايا العصبية المهمة لنظام معالجة الألم الوعائي الثلاثي التوائم. يوجد الببتيد المرتبط بجين الكالسيتونين (CGRP) في أكثر من 50% من الخلايا العصبية في العصب ثلاثي التوائم. كما يلعب دورًا في معالجة الألم في جذع الدماغ، مما يؤدي إلى زيادة الحساسية للمؤثرات. في الأطراف، يُفرز CGRP من الخلايا العصبية التي تُعصّب الأوعية الدموية، وخاصةً في الأوعية القلبية والدماغية. يُسبب CGRP توسعًا وعائيًا ملحوظًا ومستمرًا، بوساطة تنشيط مستقبلات العضلات الملساء. تُعد هذه العمليات حاسمة في الالتهاب العصبي، مما يؤدي إلى توسع الأوعية الدموية، وزيادة الحساسية، والتورم، وآليات التهابية أخرى.
أظهرت النتائج الأولية أن الببتيد المرتبط بجين الكالسيتونين (CGRP) يؤدي، عند بداية نوبة الصداع النصفي، إلى توسع الشريان الدماغي الأوسط والشريان السحائي الأوسط. وقد أثبتت دراسات لاحقة أن CGRP يحفز ويحافظ على التحسس المحيطي والمركزي. ويُعتبر التحسس خطوة أساسية في تطور نوبة الصداع النصفي واستمرار المرض. ويتأثر الالتهاب العصبي المنشأ أثناء نوبة الصداع النصفي بإطلاق CGRP بشكل مباشر نتيجة لتوسع الأوعية الدموية، وبشكل غير مباشر نتيجة لإطلاق المادة P، مما يؤدي إلى تسرب البلازما. بالإضافة إلى ذلك، يحفز CGRP تحلل الخلايا البدينة ويطلق موادًا محفزة للالتهاب وموادًا التهابية. ويؤدي إطلاق السيتوكينينات إلى تحسس الخلايا العصبية الحسية. وبصفته ناقلًا عصبيًا، ينشط CGRP انتقال الغلوتامات المشبكي في القرن الظهري ونواة العصب ثلاثي التوائم. ويؤدي ذلك إلى زيادة مركزية في التحسس وتنشيط المنعكسات المؤلمة. يُفعَّل سلوك الألم أيضًا من خلال تنشيط الخلايا العصبية المركزية، وخاصة في اللوزة الدماغية. كما تتأثر أيضًا مشاعر القلق وسلوك التجنب. يرتبط بدء نوبة الصداع النصفي بالاكتئاب القشري المنتشر (CSD). يتضمن هذا انخفاضًا موضعيًا أو انقطاعًا تامًا للنشاط العصبي في القشرة الدماغية. ينتشر هذا الاستقطاب ببطء وتدريجيًا عبر القشرة، على غرار انتشار هالة الصداع النصفي. يؤدي الاكتئاب القشري المنتشر إلى إطلاق الببتيد المرتبط بجين الكالسيتونين (CGRP)، مما ينتج عنه التهاب عصبي يشمل التحسس، وفرط الدم، وتوسع الأوعية الدموية، والتورم، وضعف الوظائف.
تشير الدراسات أيضًا إلى أن الببتيد المرتبط بجين الكالسيتونين (CGRP) يساهم في تطور فرط الحساسية للمؤثرات الحسية، وخاصة رهاب الضوء. ونظرًا لإمكانية إفراز CGRP بكميات كبيرة في الجهاز العصبي المعوي، يُعتقد أن أعراض الجهاز الهضمي، مثل ركود المعدة والغثيان والقيء، تتأثر بآليات CGRP.
ظهرت العلاقة بين تطور الصداع النصفي وCGRP في البداية من اكتشاف أن تحفيز العقدة الثلاثية التوائم يؤدي إلى إطلاق CGRP. خلال نوبة الصداع النصفي التلقائية، تُلاحظ تراكيز مرتفعة من CGRP في الوريد الوداجي. كما يُظهر اللعاب ارتفاعًا في تراكيز CGRP خلال نوبة الصداع النصفي الحادة. ويمكن خفض هذه المستويات عن طريق العلاج بالتريبتانات. حتى بين نوبات الصداع النصفي، يعاني مرضى الصداع النصفي من ارتفاع في مستويات CGRP.
قد يؤدي إعطاء CGRP عن طريق الوريد إلى تحفيز نوبات الصداع النصفي بشكل مباشر لدى مرضى الصداع النصفي. أما المرضى الذين لا يعانون من الصداع النصفي، فيُصابون بصداع دون الأعراض النموذجية للصداع النصفي بعد إعطاء CGRP. ولذلك، يُفترض أن مرضى الصداع النصفي لديهم حساسية خاصة تجاه CGRP. وأخيرًا، يمكن للحجب الانتقائي لمستقبلات CGRP أن ينهي نوبة الصداع النصفي الحادة بفعالية.
مضادات مستقبلات CGRP
استنادًا إلى هذه النتائج، تم اتباع مناهج علاجية متنوعة في السنوات الأخيرة للاستفادة من المعلومات الجديدة حول الببتيد المرتبط بجين الكالسيتونين (CGRP) في الفيزيولوجيا المرضية للصداع النصفي. في البداية، طُوِّرت مضادات مستقبلات CGRP، المعروفة باسم الجيبانتات، كفئة جديدة تمامًا من أدوية الصداع النصفي. اعتمدت آلية عملها على التثبيط التنافسي لـ CGRP الداخلي عند مستقبل CGRP. تم تطوير ستة أنواع مختلفة من الجيبانتات واختبارها في تجارب سريرية. أظهرت النتائج فعالية سريرية تفوق بشكل ملحوظ فعالية العلاج الوهمي، ولكنها كانت مماثلة لفعالية التريبتانات. من أهم مزايا الجيبانتات أنها، على عكس التريبتانات، لا تسبب تضيق الأوعية الدموية. توقف تطوير مضادات CGRP بسبب سمية الكبد عند استخدامها لفترات طويلة، ولأن فعاليتها لم تكن أفضل من فعالية التريبتانات. مع ذلك، أظهرت آلية عملها الدور المهم لـ CGRP في الفيزيولوجيا المرضية للصداع النصفي، وإمكانية استخدامه في علاج الصداع النصفي.
الأجسام المضادة وحيدة النسيلة ضد CGRP
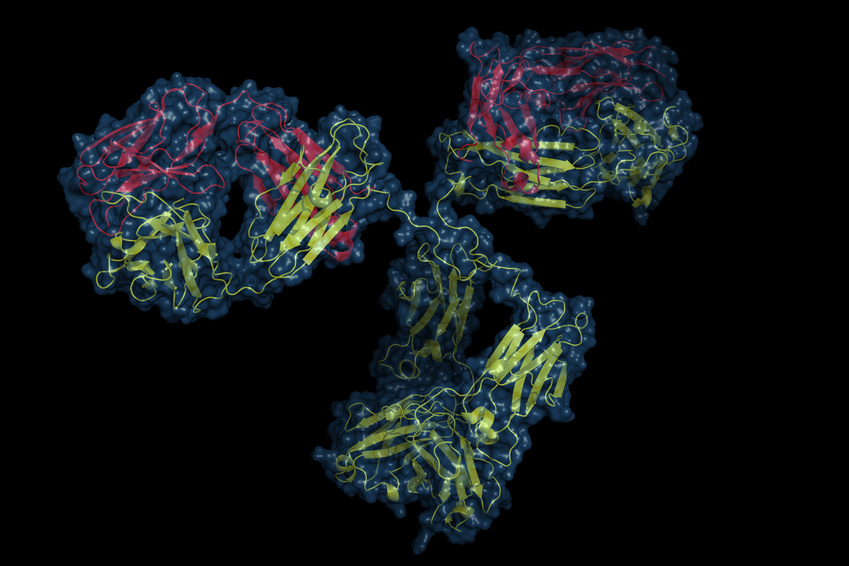
يمكن تثبيط التأثيرات البيولوجية لـ CGRP باستخدام الأجسام المضادة وحيدة النسيلة الموجهة ضد CGRP نفسه أو ضد مستقبل CGRP. حاليًا، تخضع أربعة أجسام مضادة وحيدة النسيلة لبرامج التطوير السريري لعلاج ALD-403 (شركة Alder Biopharmaceuticals)، و LY2951742 (طورتها شركة Arteau's Therapeutics وطورتها لاحقًا شركة Eli Lilly)، وLBR-101، المعروف حاليًا باسم TEV-48125 (طورته شركة Labrys Biologics-Pfizer، واستحوذت عليه شركة Teva Pharmaceuticals). أما الجسم المضاد الرابع وحيد النسيلة فيستهدف مستقبل CGRP نفسه: AMG334 (شركة Amgen، وطورته لاحقًا شركة Novartis).
ALD403 عن طريق التسريب الوريدي كل ثلاثة أشهر. ومن المتوقع صدور نتائج المرحلة الثانية (ب) من التجارب السريرية للوقاية من الصداع النصفي المزمن في يوليو 2016. وتُجرى حاليًا تجربة سريرية من المرحلة الثالثة لدراسة الوقاية من نوبات الصداع النصفي المتكررة، ومن المقرر أن تنتهي هذه التجربة في أبريل 2017. كما يُخطط لبدء تجربة سريرية أخرى من المرحلة الثالثة في عام 2016. بالإضافة إلى ذلك، ستُحلل تجربة سريرية من المرحلة الثانية (ب) مدى استخدام المرضى المصابين بالصداع النصفي العرضي لدواء ALD403 ذاتيًا.
عقار TEV-48125 حاليًا للدراسة في المرحلة الثالثة من التجارب السريرية. ومن المتوقع الانتهاء من تحليل فعاليته في علاج الصداع النصفي المزمن في أكتوبر 2017.
LY2951742 للدراسة في المرحلة الثانية التي أُنجزت في أغسطس 2015. حللت الدراسة التأثير الوقائي لإعطاء الدواء تحت الجلد كل أربعة أسابيع لمدة 12 أسبوعًا على الصداع النصفي العرضي. وقد أظهرت الدراسة فعالية ملحوظة مقارنةً بالدواء الوهمي في تقليل عدد أيام الصداع النصفي. وتجري حاليًا دراسات إضافية من المرحلة الثالثة. من المتوقع الانتهاء من دراسة تبحث في فعالية الدواء في علاج الصداع النصفي العرضي بحلول ديسمبر 2017. ومن المتوقع الانتهاء من دراسة أخرى تبحث في فعالية الدواء في علاج الصداع النصفي المزمن في أبريل 2018. كما يُتوقع الانتهاء من دراسة إضافية مفتوحة التسمية وطويلة الأمد في سبتمبر 2017.
دواء AMG334 حاليًا للدراسة في المرحلة الثانية من التجارب السريرية لتقييم فعاليته الوقائية في علاج الصداع النصفي المزمن. وسيتم تحليل فعاليته وسلامته على المدى الطويل في تجربة سريرية أخرى من المرحلة الثانية، ومن المتوقع إتمامها بحلول يوليو 2017. كما من المقرر إتمام تجربتين سريريتين من المرحلة الثالثة لدراسة فعاليته الوقائية في علاج الصداع النصفي العرضي بحلول أكتوبر 2017 وفبراير 2018 على التوالي.
التوافق والسلامة
بالنظر إلى الخبرة المكتسبة من تطوير مضادات مستقبلات الببتيد المرتبط بجين الكالسيتونين (CGRP)، فإن نتائج الدراسات طويلة الأمد المتعلقة بتحمل وسلامة الأجسام المضادة وحيدة النسيلة ضد CGRP لا تزال قيد الانتظار. لا تعمل هذه الأجسام المضادة على حجب توسع الأوعية الدموية الناتج عن CGRP بشكل انتقائي في جميع أنحاء الجسم. ولا تزال آثارها على تثبيط توسع الأوعية الدموية القلبية الوعائية، على سبيل المثال، أثناء الإجهاد أو نقص التروية، بالإضافة إلى تفاعلاتها في علاج ارتفاع ضغط الدم الشرياني، غير واضحة. ومن المحتمل حدوث تفاعلات مع تدفق الدم القلبي والدماغي. ومع ذلك، لم تُظهر الدراسات السابقة أي تأثيرات على تخطيط كهربية القلب أو غيرها من المؤشرات الديناميكية الدموية. كما يبقى احتمال حدوث تفاعلات مناعية لدى المرضى عند إعطاء هذه الأجسام المضادة وحيدة النسيلة سؤالًا مفتوحًا.
فعالية
لا شك أن خيارات العلاج الوقائي الحالية للصداع النصفي غير مُرضية لكثير من المرضى. كما أثبتت الأجسام المضادة وحيدة النسيلة عدم فعاليتها لدى بعض المرضى الذين خضعوا للدراسة في تجارب سريرية سابقة. على سبيل المثال، لم يحقق 47% من المرضى الذين تلقوا جرعة منخفضة و45% ممن تلقوا جرعة عالية من TEV-41825 انخفاضًا بنسبة 50% في وتيرة الصداع النصفي من حيث عدد أيام الصداع. يبقى صحيحًا أن الصداع النصفي مرض معقد يتوسطه مجموعة واسعة من المسارات الفيزيولوجية المرضية وجزيئات متنوعة. يختلف دور CGRP من مريض لآخر. مع ذلك، يبدو أن هناك مجموعة فرعية من المرضى يستجيبون بفعالية كبيرة للعلاج بالأجسام المضادة وحيدة النسيلة ضد CGRP. أفاد أكثر من 15% من المرضى المُعالَجين بتوقف نوبات الصداع النصفي تمامًا. لذلك، سيوفر هذا العلاج خيارات فعالة للغاية لبعض المرضى، بينما لن يستفيد منه آخرون بشكل كافٍ. علاوة على ذلك، لا تزال فعاليته المقارنة مع الأدوية الوقائية الحالية قيد الدراسة. مع ذلك، هناك أمر واحد واضح: يجب أن تشمل الوقاية من الصداع النصفي مجموعة متنوعة من الاستراتيجيات. يُعدّ العلاج المُخصّص والمُصمّم خصيصًا لكل حالة ضروريًا، لا سيما في الحالات الشديدة والمزمنة. وحتى مع استخدام الأجسام المضادة وحيدة النسيلة، لا يُمكن توقّع علاج يقضي على الصداع النصفي بحقنة واحدة ويُمكّن المريض من عيش حياته كما يشاء.










لقد عانيت من الصداع النصفي لمدة 30 عاما.
في الأوقات الصعبة مع هجومين 3 أيام في الأسبوع. مع 7 أيام من الأسبوع، لا يوجد الكثير من الوقت المتبقي. وأنا أتفق أيضًا مع التعليقات التي سأجعلها متاحة للدراسة على الفور.
نظرًا لكثرة الأقراص التي تناولتها، فقد مررت بالفعل بالانسحاب لعدة أشهر بسبب الصداع الناتج عن تناول الأقراص.
آمل أن أتحسن حتى لا أفقد وظيفتي أيضًا.
وأنا أتفق مع السيدة جيل. أبلغ من العمر 50 عامًا تقريبًا وأعاني من الصداع النصفي منذ أن كنت مراهقًا. ولسوء الحظ، فإن الأمل في أن تتحسن الأمور مع انقطاع الطمث لم يتحقق بالنسبة لي بعد. إذا كان لديك حاجة للمشاركين في الدراسة. انا مشارك معكم!
أنا أيضًا عانيت من الصداع النصفي الشديد وصداع التوتر لمدة 28 عامًا. أعاني حاليًا من فترة من الألم الشديد مرة أخرى، لدرجة أنني لا أستطيع العمل. عمري 57 عامًا وقد فقدت تقريبًا كل أمل في التخلص من الألم. سأكون سعيدًا جدًا إذا تمكنت من اختبار حقن الأجسام المضادة.
أعاني من الصداع النصفي منذ 45 عامًا ولم أتمكن من العمل بسبب الصداع النصفي المزمن.
حاليا 10-15 يوما في الشهر. بفضل Ascotop يمكنني التعامل مع هذا بطريقة أو بأخرى الآن. سأجعل نفسي متاحًا على الفور للمشاركة في الدراسات.
ما زلت أتمنى التطعيم، وأخشى ما سيحدث مع الدواء مع تقدمي في السن (عمري 60 عامًا تقريبًا).
سيكون جميلاً لو عشت لأرى هذه الثورة.