الصداع النصفي هو أحد أخطر الأمراض المعيقة التي تصيب البشرية. وفقا لمحة عامة حديثة من منظمة الصحة العالمية، يتم إدراج الصداع النصفي باعتباره المرض السادس الأكثر إعاقة. إذا أخذت في الاعتبار مضاعفات الصداع الناجم عن الإفراط في استخدام الدواء، فإن الصداع النصفي يحتل المركز الثالث. إذا قمت بدمج الأشكال المختلفة لـ 367 نوعًا من الصداع المعروفة اليوم، فإن الصداع النصفي والصداع يعدان من أكثر الأمراض البشرية خطورة وشيوعًا وإعاقة شديدة.
تشمل خيارات العلاج الحالية للصداع النصفي العلاجات الوقائية وعلاج نوبات الصداع الحادة. لا تجد نسبة كبيرة من المصابين تحسنًا كافيًا من خلال إجراءات العلاج الوقائي. حتى العلاج الهجومي الحالي لا يمكن أن يحقق راحة فعالة مع خيارات العلاج السابقة؛ قد تكون هناك موانع أو عدم تحمل.
قدمت الدراسات الحالية في السنوات الأخيرة أدلة عديدة على أن الببتيد المرتبط بجين الكالسيتونين، أو اختصارًا CGRP، يلعب دورًا مهمًا في تطور الصداع النصفي وصيانته وتوقيته. CGRP هو ببتيد عصبي يتكون من 37 حمضًا أمينيًا. يتم ترميزه بواسطة نفس الجين مثل هرمون الكالسيتونين.
ولذلك تم وضع CGRP في محور خيارات علاج الصداع النصفي الجديدة. يمثل تطوير مضادات مستقبلات CGRP، المعروفة باسم Gepante، فئة جديدة من الأدوية لعلاج نوبات الحادة ، إلا أن تطورها توقف بسبب تسمم الكبد.
يهدف البحث الحالي بشكل مكثف إلى تطوير أجسام مضادة وحيدة النسيلة ضد CGRP. تلعب كل من الآليات الوعائية والعصبية دورًا في الفيزيولوجيا المرضية المعقدة للصداع النصفي. السيروتونين (5-هيدروكسي تريبتامين، 5-HT)، وأكسيد النيتريك وCGRP هي مواد رئيسية تشارك في تطور آلام الصداع النصفي. يتكون CGRP من 37 حمض أميني. تم اكتشافه منذ حوالي 30 عامًا. تم العثور على CGRP على نطاق واسع في الجهاز العصبي المحيطي والمركزي. يتم تعصيب كل عضو رئيسي بواسطة ألياف عصبية تحتوي على CGRP. على وجه الخصوص، توجد مستقبلات CGRP وCGRP في الهياكل التشريحية التي تعتبر مهمة لتطور الصداع النصفي. وتشمل هذه القشرة الدماغية والسحايا وتحت المهاد والمخيخ وجذع الدماغ. تم العثور على CGRP أيضًا في العديد من الخلايا العصبية المهمة لنظام معالجة الألم في الأوعية الدموية الثلاثية التوائم. في العصب ثلاثي التوائم، يمكن العثور على CGRP في أكثر من 50% من الخلايا العصبية. يعد CGRP مهمًا أيضًا في معالجة الألم في جذع الدماغ. يؤدي إلى حساسية تصور المحفزات. في المحيط، يتم إطلاق CGRP بواسطة الخلايا العصبية التي تعصب الأوعية الدموية، خاصة في الأوعية القلبية والأوعية داخل الجمجمة. يؤدي CGRP إلى توسع الأوعية الدموية بشكل واضح ومستدام. ويتم ذلك عن طريق تنشيط المستقبلات في خلايا العضلات الملساء. ترتبط هذه العمليات بشكل كبير بالالتهاب العصبي. والنتيجة هي توسع الأوعية الدموية والحساسية والتورم والآليات الالتهابية الأخرى.
أظهرت النتائج الأولية أنه في بداية نوبة الصداع النصفي، يؤدي CGRP إلى توسع الشريان الدماغي الأوسط والشريان السحائي الأوسط. أظهرت دراسات أخرى أن CGRP يحفز ويحافظ على التحسس المحيطي والمركزي. يعتبر التحسس خطوة أساسية في تطور نوبة الصداع النصفي واستمرارية المرض. يتم تعديل الالتهاب العصبي المرتبط بنوبة الصداع النصفي عن طريق إطلاق CGRP مباشرة بسبب توسع الأوعية وبشكل غير مباشر بسبب إطلاق المادة P مما يؤدي إلى تسرب البلازما. بالإضافة إلى ذلك، يحدث تحلل حبيبات الخلايا البدينة ويتم إطلاق المواد المسببة للالتهابات والالتهابات. يؤدي إطلاق السيتوكينين إلى حساسية الخلايا العصبية الحسية. باعتباره مُعدِّلًا عصبيًا، يقوم CGRP بتنشيط انتقال الغلوتامات المتشابك في القرن الظهري ونواة مثلث التوائم. وهذا يؤدي إلى زيادة مركزية أخرى في حساسية وتفعيل ردود الفعل مسبب للألم. يتم أيضًا تنشيط سلوك الألم عن طريق تنشيط الخلايا العصبية المركزية، خاصة في اللوزة الدماغية. يتأثر أيضًا سلوك الخوف والتجنب. يرتبط بدء نوبة الصداع النصفي بالاكتئاب القشري المنتشر (CSD). يتم تقليل نشاط الخلايا العصبية في القشرة الدماغية محليًا أو انقطاعه تمامًا. وينتشر زوال الاستقطاب هذا تدريجيًا مكانيًا فوق القشرة الدماغية، وهو ما يشبه انتشار هالة الصداع النصفي. يؤدي CSD إلى إطلاق CGRP مما يؤدي إلى التهاب عصبي بما في ذلك التحسس، احتقان الدم، توسع الأوعية، التورم، والضعف الوظيفي.
تظهر الدراسات أيضًا أن CGRP متورط في تطور فرط الحساسية للمحفزات الحسية، وخاصة رهاب الضوء. نظرًا لأنه يمكن أيضًا إطلاق CGRP على نطاق واسع في الجهاز العصبي المعوي، فمن المعتقد أن أعراض الجهاز الهضمي مثل ركود المعدة والغثيان والقيء يتم تعديلها بواسطة آليات CGRP.
العلاقة بين تطور الصداع النصفي وCGRP ظهرت في البداية من اكتشاف أن تحفيز العقدة الثلاثية التوائم يؤدي إلى إطلاق CGRP. تم العثور على CGRP بتركيزات مرتفعة في الوريد الوداجي أثناء نوبة الصداع النصفي التلقائي. تم العثور أيضًا على زيادة في تركيزات CGRP في اللعاب أثناء نوبة الصداع النصفي الحادة. ويمكن تقليل هذه عن طريق العلاج باستخدام التريبتان. يتم أيضًا زيادة مستويات CGRP بين نوبات الصداع النصفي لدى المرضى الذين يعانون من الصداع النصفي.
يمكن أن يؤدي إعطاء CGRP عن طريق الوريد إلى حدوث نوبات الصداع النصفي بشكل مباشر لدى المصابين بالصداع النصفي. المرضى الذين لا يعانون من الصداع النصفي يعانون من الصداع دون الأعراض النموذجية للصداع النصفي بعد تناول CGRP. ولذلك يُعتقد أن الذين يعانون من الصداع النصفي لديهم حساسية خاصة تجاه CGRP. وأخيرًا، يمكن للحجب الانتقائي لمستقبل CGRP أن يوقف بشكل فعال نوبة الصداع النصفي الحادة.
مضادات مستقبلات CGRP
بناءً على هذه النتائج، تم اتباع طرق مختلفة بشكل منهجي في السنوات الأخيرة لاستخدام النتائج الجديدة حول CGRP علاجيًا في الفيزيولوجيا المرضية للصداع النصفي. كفئة جديدة تمامًا من أدوية الصداع النصفي، تم تطوير ما يسمى بـ Gepante في البداية كمضادات لمستقبلات CGRP. استندت آلية عملها على التثبيط التنافسي لـ CGRP الخاص بالجسم عند مستقبل CGRP. وقد تم الآن تطوير واختبار ستة أنواع مختلفة من منتجات جيبانتس في الدراسات السريرية. وكانت النتيجة تأثيرًا سريريًا كان متفوقًا بشكل كبير على تأثير الأدوية الوهمية، ولكنه مشابه لتأثير أدوية التريبتان. الميزة الرئيسية لـ Gepante هي أنها، على عكس أدوية التريبتان، لا تؤدي إلى انقباض الأوعية الدموية. توقف تطوير مضادات CGRP بسبب سمية الكبد عند استخدامها على المدى الطويل ولأنها لم تكن أكثر فعالية من أدوية التريبتان. ومع ذلك، أظهر أسلوب عملهم الدور الهام لـ CGRP في الفيزيولوجيا المرضية للصداع النصفي وإمكانية استخدام CGRP في علاج الصداع النصفي.
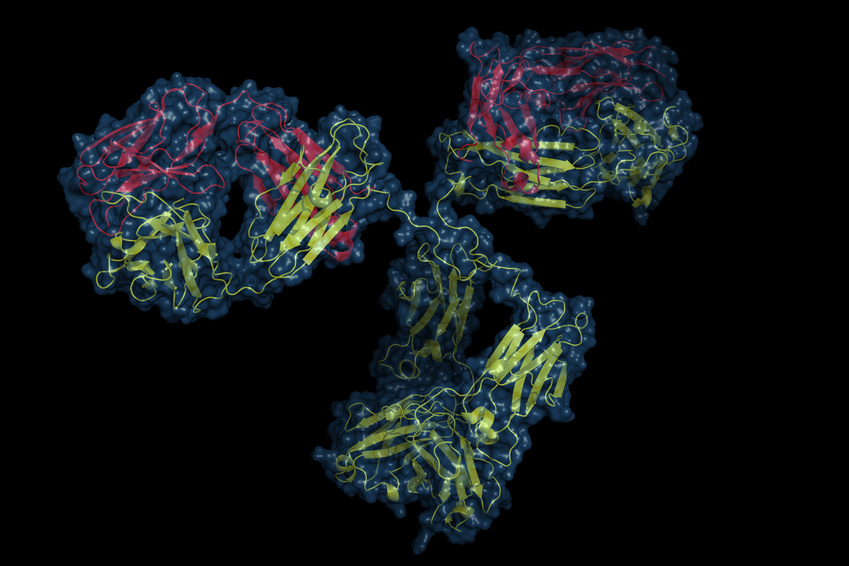
الأجسام المضادة وحيدة النسيلة ضد CGRP
يمكن بدلاً من ذلك حظر التأثير البيولوجي لـ CGRP بواسطة الأجسام المضادة وحيدة النسيلة ضد CGRP نفسه أو ضد مستقبل CGRP. يوجد حاليًا أربعة أجسام مضادة وحيدة النسيلة للعلاج الوقائي للصداع النصفي العرضي أو المزمن. يتم استهداف الببتيد العصبي نفسه بواسطة ثلاثة أجسام مضادة وحيدة النسيلة، ALD-403 (شركة Alder Biopharmaceuticals)، و LY2951742 (التي طورتها شركة Arteau's Therapeutics ومزيد من التطوير بواسطة Eli Lilly) وLBR-101، الاسم الحالي TEV-48125 (الذي طورته شركة Labrys Biologics-Pfizer، التي تم الحصول عليها بواسطة شركة تيفا للأدوية). يستهدف الجسم المضاد وحيد النسيلة الرابع مستقبل CGRP نفسه، AMG334 (Amgen, Inc.؛ مزيد من التطوير بواسطة Novartis).
سيتم ضخ ALD403 من المتوقع ظهور نتائج دراسة المرحلة 2ب في يوليو 2016 للوقاية من الصداع النصفي المزمن. تبحث دراسة المرحلة الثالثة في الوقاية من الصداع النصفي العرضي المتكرر. ومن المقرر أن تنتهي الدراسة في أبريل 2017. ومن المقرر أن تبدأ دراسة أخرى للمرحلة الثالثة في عام 2016. بالإضافة إلى ذلك، ستقوم دراسة المرحلة 2 ب بتحليل الإدارة الذاتية من قبل المرضى الذين يعانون من الصداع النصفي العرضي لـ ALD403.
تتم حاليًا دراسة TEV-48125 ومن المقرر الانتهاء من تحليل فعالية الصداع النصفي المزمن في أكتوبر 2017.
LY2951742 في دراسة المرحلة الثانية التي اكتملت في أغسطس 2015. تم تحليل التأثير الوقائي على الصداع النصفي العرضي عن طريق الإعطاء تحت الجلد على فترات أربعة أسابيع على مدى 12 أسبوعًا. وقد وجد أنه فعال بشكل كبير مقارنة بالعلاج الوهمي في تقليل عدد أيام الصداع النصفي. ويجري حاليًا إجراء المزيد من دراسات المرحلة الثالثة. ومن المتوقع الانتهاء من دراسة فعالية الصداع النصفي العرضي بحلول ديسمبر 2017. ومن المقرر الانتهاء من دراسة أخرى حول فعالية الصداع النصفي المزمن في أبريل 2018. ومن المقرر الانتهاء من دراسة إضافية مفتوحة طويلة المدى في سبتمبر 2017.
AMG334 في دراسة المرحلة الثانية لتأثيره الوقائي على الصداع النصفي المزمن. سيتم تحليل التأثيرات طويلة المدى والسلامة في دراسة أخرى للمرحلة الثانية ويجب الانتهاء منها بحلول يوليو 2017. ومن المقرر الانتهاء من دراستين من المرحلة الثالثة حول التأثير الوقائي على الصداع النصفي العرضي بحلول أكتوبر 2017 وفبراير 2018، على التوالي.
التحمل والسلامة
في ضوء الخبرة المكتسبة في تطوير مضادات CGRP، يجب انتظار النتائج المتعلقة بتحمل وسلامة الأجسام المضادة وحيدة النسيلة ضد CGRP في الدراسات طويلة المدى. لا تمنع الأجسام المضادة بشكل انتقائي توسع الأوعية بوساطة CGRP في جميع أنحاء الجسم. التأثيرات على تثبيط توسع الأوعية القلبية الوعائية، على سبيل المثال أثناء الإجهاد أو نقص التروية، وكذلك التفاعلات في علاج ارتفاع ضغط الدم الشرياني مفتوحة. التفاعلات على تدفق الدم القلبي والدماغي يمكن تصورها. ومع ذلك، أظهرت الدراسات السابقة عدم وجود آثار على تخطيط القلب أو غيرها من عوامل الدورة الدموية. إن التحفيز المحتمل للتفاعلات المناعية لدى المريض عند إعطاء الأجسام المضادة وحيدة النسيلة غير واضح أيضًا.
فعالية
ليس هناك شك في أن خيارات العلاج الوقائي الحالية للصداع النصفي غير مرضية للعديد من المرضى. كما أن الأجسام المضادة وحيدة النسيلة ليست فعالة لدى بعض المرضى الذين تم فحصهم في برامج الدراسة السابقة. على سبيل المثال، 47% مع جرعة منخفضة و45% مع جرعة عالية من TEV-41825 لم يحققوا انخفاضًا بنسبة 50% في تكرار الصداع النصفي من حيث أيام الصداع. لا يزال ما يلي ينطبق: الصداع النصفي هو مرض معقد تتوسطه مسارات فيزيولوجية مرضية مختلفة جدًا ومجموعة واسعة من الجزيئات. تختلف أهمية CGRP من مريض لآخر. ومع ذلك، يبدو أن هناك مجموعة فرعية من المرضى الذين يستجيبون بفعالية كبيرة للعلاج بالأجسام المضادة وحيدة النسيلة ضد CGRP. أبلغ أكثر من 15% من المرضى المعالجين عن توقف تام لنوبات الصداع النصفي. بالنسبة لبعض المرضى، سيحتوي العلاج على خيارات فعالة للغاية، لكن آخرين لن يستفيدوا منه بشكل كافٍ. وما يتبقى أيضًا أن نرى هو الفعالية النسبية للأدوية الوقائية السابقة. ومع ذلك، فمن الواضح بالفعل أن الوقاية من الصداع النصفي يجب أن تنطوي على استراتيجيات مختلفة. يعد العلاج الفردي المختلف ضروريًا في كل حالة على حدة، خاصة في الحالات الشديدة والمزمنة. لا يمكن توقع العلاج الذي يوقف الصداع النصفي عن طريق الحقن ويسمح لك بالعيش كما تريد، حتى مع الأجسام المضادة وحيدة النسيلة.









لقد عانيت من الصداع النصفي لمدة 30 عاما.
في الأوقات الصعبة مع هجومين 3 أيام في الأسبوع. مع 7 أيام من الأسبوع، لا يوجد الكثير من الوقت المتبقي. وأنا أتفق أيضًا مع التعليقات التي سأجعلها متاحة للدراسة على الفور.
نظرًا لكثرة الأقراص التي تناولتها، فقد مررت بالفعل بالانسحاب لعدة أشهر بسبب الصداع الناتج عن تناول الأقراص.
آمل أن أتحسن حتى لا أفقد وظيفتي أيضًا.
وأنا أتفق مع السيدة جيل. أبلغ من العمر 50 عامًا تقريبًا وأعاني من الصداع النصفي منذ أن كنت مراهقًا. ولسوء الحظ، فإن الأمل في أن تتحسن الأمور مع انقطاع الطمث لم يتحقق بالنسبة لي بعد. إذا كان لديك حاجة للمشاركين في الدراسة. انا مشارك معكم!
أنا أيضًا عانيت من الصداع النصفي الشديد وصداع التوتر لمدة 28 عامًا. أعاني حاليًا من فترة من الألم الشديد مرة أخرى، لدرجة أنني لا أستطيع العمل. عمري 57 عامًا وقد فقدت تقريبًا كل أمل في التخلص من الألم. سأكون سعيدًا جدًا إذا تمكنت من اختبار حقن الأجسام المضادة.
أعاني من الصداع النصفي منذ 45 عامًا ولم أتمكن من العمل بسبب الصداع النصفي المزمن.
حاليا 10-15 يوما في الشهر. بفضل Ascotop يمكنني التعامل مع هذا بطريقة أو بأخرى الآن. سأجعل نفسي متاحًا على الفور للمشاركة في الدراسات.
ما زلت أتمنى التطعيم، وأخشى ما سيحدث مع الدواء مع تقدمي في السن (عمري 60 عامًا تقريبًا).
سيكون جميلاً لو عشت لأرى هذه الثورة.