Zahlreiche für die Pathophysiologie der Migräne relevante Gehirnareale, das kraniale Gefäßsystem, die Dura mater sowie das Hinterhorn des Rückenmarks exprimieren Estrogen-Rezeptoren. Dadurch können schmerzhafte Reize moduliert werden. Migräneattacken können in zeitlicher Relation zum menstruellen Fenster auftreten. Migräne ist ein Risikofaktor für Schlaganfall und andere vaskuläre Ereignisse. Es besteht umfangreiche Evidenz, dass ein erhöhtes Risiko für ischämische Schlaganfälle sowohl mit der Migräne ohne Aura als auch mit der Migräne mit Aura assoziiert ist. Da auch das Schlaganfallrisiko bei Einsatz von hormonellen Kontrazeptiva erhöht sein kann, ist die Frage bedeutsam, welche Handlungsmöglichkeiten in der Praxis bestehen.
Klassifikation der Migräne in Relation zur Menstruation
Die aktuelle 3. Auflage der Internationalen Kopfschmerzklassifikation ICHD3 [1] hat Migräneattacken, die in zeitlicher Relation zum menstruellen Fenster auftreten, wie auch die Vorauflagen im Hauptteil keinen Platz zugewiesen. Die erste Auflage im Jahre 1988 [2] führte für die Migräne im Zusammenhang mit der Menstruation keinerlei formelle Kriterien auf. Aber bereits in dieser ersten Auflage wurde im Kommentarteil angemerkt, dass bei einigen Frauen Migräneattacken ohne Aura exklusiv mit der Menstruation auftreten können. Diese wurde als „sogenannte menstruelle Migräne“ bezeichnet. Der Begriff sollte nur dann verwendet werden, wenn mindestens 90% der Attacken im Zeitraum 2 Tage vor der Menstruation bis zum letzten Tag der Menstruation auftraten. In der zweiten Auflage der internationalen Kopfschmerzklassifikation 2004 [3] wurden im Anhang erstmals zwei Unterformen der Migräne im Zusammenhang mit der Menstruation definiert. Die sogenannte „reine menstruelle Migräne“ bezeichnet Attacken, die ausschließlich im Zusammenhang mit der Menstruation auftreten. Im Gegensatz dazu treten bei der sogenannten „menstruationsassoziierten Migräne“ zusätzlich Attacken auch zu anderen Zeiten des Zyklus auf. Bei beiden Formen handelte es sich um Untergruppen ausschließlich der Migräne ohne Aura. Im Anhang der Internationalen Kopfschmerzklassifikation werden Forschungskriterien für Kopfschmerzentitäten beschrieben, die bisher durch wissenschaftliche Studien noch nicht ausreichend validiert sind. Sowohl die Erfahrung der Mitglieder des Kopfschmerzklassifikationskomitees als auch Veröffentlichungen unterschiedlicher Qualität legen die Existenz dieser im Anhang aufgeführten Entitäten nahe, die als eigenständige Erkrankungen angesehen werden können, bei denen aber weitere wissenschaftlichen Belege erbracht werden müssen, ehe sie formal akzeptiert werden können. Gelingt dies, können diese Diagnosen aus dem Anhang bei der nächsten Revision der Klassifikation in den Hauptteil übernommen werden.
Auch in der 3. Auflage der internationalen Kopfschmerzklassifikation aus dem Jahre 2018 findet man die „reine menstruelle Migräne“ und die „menstruationsassoziierte Migräne“ weiterhin nur im Anhang. Für beide Diagnosen wird gefordert, dass die Migräneattacken am Tage 1 ± 2 der Menstruation (d. h. Tag −2 bis +3) der Menstruation in mindestens 2 von 3 Menstruationszyklen auftreten (Tabelle 1, Abb. 1). Erweitert wurden die Kriterien nun jedoch zusätzlich um eine Unterform mit Aura, obwohl menstruelle Migräneattacken meist ohne Auren verlaufen. Definiert werden damit eine reine menstruelle Migräne mit und ohne Aura sowie eine menstruationsassoziierte Migräne mit und ohne Aura. Werden die Formen reine menstruelle Migräne und menstruationsassoziierte Migräne zusammengefasst, spricht man übergreifend von der sogenannten „menstruellen Migräne“ [4].
Tabelle 1. Diagnostische Kriterien der ICHD-3 für Migräne innerhalb und außerhalb des menstruellen Zeitfensters
———————————————————————————
A1.1.1 Rein menstruelle Migräne ohne Aura
- Attacken bei einer menstruierenden Frau1, welche die Kriterien einer 1.1 Migräne ohne Aura und Kriterium B unten erfüllen
- Die Attacken treten ausschließlich am Tage 1 ± 2 (d. h. Tag −2 bis +3) der Menstruation1 in mindestens 2 von 3 Menstruationszyklen auf und zu keiner anderen Zeit des Zyklus.
A1.1.2 Menstruationsassoziierte Migräne ohne Aura
- Attacken bei einer menstruierenden Frau, welche die Kriterien einer 1.1 Migräne ohne Aura sowie Kriterium B unten erfüllen
- Die Attacken treten am Tage 1 ± 2 der Menstruation (d. h. Tag −2 bis +3) der Menstruation in mindestens 2 von 3 Menstruationszyklen auf, zusätzlich aber auch zu anderen Zeiten des Zyklus.
A1.1.3 Nicht menstruationsassoziierte Migräne ohne Aura
- Attacken bei einer menstruierenden Frau, welche die Kriterien einer 1.1 Migräne ohne Aura sowie das Kriterium B unten erfüllen
- Attacken, welche nicht das Kriterium B für eine A1.1.1 rein menstruelle Migräne ohne Aura oder A1.1.2 menstruationsassoziierte Migräne ohne Aura erfüllen.
———————————————————————————
A1.2.0.1 Rein menstruelle Migräne mit Aura
- Attacken bei einer menstruierenden Frau1, welche die Kriterien einer 1.2 Migräne mit Aura und Kriterium B unten erfüllen
- Die Attacken treten am Tage 1 ± 2 der Menstruation (d. h. Tag −2 bis +3) der Menstruation in mindestens 2 von 3 Menstruationszyklen auf, zusätzlich aber auch zu anderen Zeiten des Zyklus.
A1.2.0.2 Menstruationsassoziierte Migräne mit Aura
- Attacken bei einer menstruierenden Frau, welche die Kriterien einer 1.2 Migräne mit Aura und Kriterium B unten erfüllen
- Die Attacken treten am Tage 1 ± 2 der Menstruation (d. h. Tag −2 bis +3) der Menstruation in mindestens 2 von 3 Menstruationszyklen auf, zusätzlich aber auch zu anderen Zeiten des Zyklus.
A1.2.0.3 Nicht menstruationsassoziierte Migräne mit Aura
- Attacken bei einer menstruierenden Frau, welche die Kriterien einer 1.2 Migräne mit Aura und Kriterium B unten erfüllen
- Attacken, welche nicht das Kriterium B für eine A1.2.0.1 rein menstruelle Migräne mit Aura oder A1.2.0.2 menstruationsassoziierte Migräne mit Aura erfüllen.
———————————————————————————
Für die Zwecke der ICHD-3 wird die Menstruation als endometriale Blutung infolge des normalen endogenen Menstruationszyklusses oder eines Entzuges von externen Gestagenen angesehen, letzteres gilt für kombinierte orale Kontrazeptiva und eine zyklische Hormonersatztherapie (Abb. 1). Die Unterscheidung zwischen einer rein menstruellen Migräne ohne Aura und einer menstruationsassoziierten Migräne ohne Aura ist nach der ICHD-3 von Bedeutung, weil eine Hormonprophylaxe bei Letzterer mit höherer Wahrscheinlichkeit wirksam ist [1].
Mehr als 50 % der Frauen mit Migräne berichten über einen Zusammenhang zwischen Menstruation und Migräne [5]. Die Prävalenz in verschiedenen Studien variiert aufgrund der unterschiedlichen diagnostischen Kriterien. Die Prävalenz der reinen menstruellen Migräne ohne Aura schwankt zwischen 7 % und 14 % bei Migränepatientinnen, während die Prävalenz der menstruationsbedingten Migräne ohne Aura zwischen 10 % und 71 % bei Migränepatientinnen variiert. Etwa eine von drei bis fünf Migränepatientinnen hat im Zusammenhang mit der Menstruation eine Migräneattacke ohne Aura [5]. Viele Frauen neigen dazu, den Zusammenhang zwischen Menstruation und Migräneattacken überzubewerten; zu Forschungszwecken erfordert die Diagnose den durch die Migräne-App oder Tagebuchaufzeichnungen belegten, prospektiv dokumentierten Nachweis über ein Minimum von drei Zyklen [1].
Die Mechanismen der Migräne unterscheiden sich möglicherweise in Abhängigkeit davon, ob die endometriale Blutung als Folge des normalen endogenen Menstruationszyklusses oder eines Entzuges von externen Gestagenen (wie bei kombinierten oralen Kontrazeptiva und einer zyklischen Hormonersatztherapie) auftritt. So resultiert der endogene Menstruationszyklus aus komplexen hormonellen Veränderungen der Achse von Hypothalamus, Hypophyse und Ovarien, die den Eisprung auslösen, welche wiederum durch Einnahme kombinierter oraler Kontrazeptiva unterdrückt wird. Diese Subpopulationen sollten daher pathophysiologisch getrennt betrachtet werden, obwohl die Diagnosekriterien nicht voneinander abzugrenzen sind.
Es gibt Hinweise, dass zumindest bei einigen Frauen menstruelle Migräneattacken durch einen Estrogenentzug ausgelöst werden können, auch wenn möglicherweise andere hormonelle oder biochemische Veränderungen zu diesem Zeitpunkt des Zyklus ebenfalls relevant sein können [4]. Wenn eine rein menstruelle Migräne oder menstruationsassoziierte Migräne mit einem exogenen Estrogenentzug in Zusammenhang stehen, sollten beide Diagnosen, rein menstruelle Migräne ohne Aura bzw. menstruationsassoziierte Migräne ohne Aura und Estrogenentzugskopfschmerz vergeben werden. Der Zusammenhang mit der Menstruation kann sich im Laufe der fortpflanzungsfähigen Lebensspanne einer Frau ändern.
Effekt von Hormonen auf Kopfschmerzen
Der Effekt von Hormonen auf Kopfschmerzen wurde im Hauptteil „sekundäre Kopfschmerzen“ in der 2. Auflage 2004 (ICHD-2) der internationalen Kopfschmerzklassifikation aufgenommen [3]. Die Kriterien betreffen Kopfschmerzen, die im Zusammenhang mit einer Hormongabe neu aufgetreten sind oder vorbestehende Kopfschmerzen, die sich dadurch verschlechtern. Die Kriterien fordern, dass die Kopfschmerzen sich nach Absetzen der Hormone verbessern oder bei vorbestehenden Kopfschmerzen wieder das frühere Muster auftritt.
In der 3. Auflage 2018 (ICHD-3) [1] wurde für die Diagnose eines Kopfschmerzes, zurückzuführen auf die Gabe von exogenen Hormonen, das Vorliegen von Kopfschmerzen an mindestens 15 Tagen pro Monat gefordert. Die Diagnose eines Estrogen-Entzugskopfschmerzes nach ICHD-3 setzt voraus, dass die Kopfschmerzen innerhalb von 5 Tagen nach Absetzen des Östrogens einsetzen, wenn Frauen Estrogene über mindestens drei oder mehr Wochen eingenommen haben.
Estrogene und Migräne
Im Jahre 1972 beschrieb Somerville, dass die intramuskuläre Injektion kurz vor der Menstruation von Estradiolvalerat, ein pro-drug Ester von 17 β-Estradiol, das Eintreten einer menstruell assoziierten Migräneattacke verzögern kann [6]. Es wurde eine Schwellenkonzentration von zirkulierendem 17-β-Estradiol von 45-50 pg/ml identifiziert, unterhalb der eine Migräneattacke ausgelöst werden kann. Diese Schwelle zeigte sich auch bei Frauen in der Menopause, die sich einer Hormonersatztherapie mit intramuskulären 17 β-Estradiol unterzogen hatten. Aufgrund dieser Daten wurde die Hypothese aufgestellt, dass Migräneattacken im menstruellen Fenster durch einen Estrogen-Abfall ausgelöst werden. Darauf basierend wurde postuliert, dass physiologische Estrogen-Fluktuationen eine Rolle in der Migräneentstehung spielen. Diese Annahme wurde durch den Befund unterstützt, dass eine besondere Anfälligkeit für Migräneattacken während des Estrogenabfalls in der späten Lutealphase auftritt. Unterschiede in den Maximalwerten oder im durchschnittlichen Tageskonzentrationswert von Estrogen während der Ovulationszyklen bei Migränepatientinnen im Vergleich zu gesunden Kontrollpersonen ließen sich jedoch nicht nachweisen [4, 7].
Estrogen und Nervensystem
Das am meisten relevante endogene Estrogen ist 17 β-Estradiol [8]. Es hat Zugang zum zentralen Nervensystem durch passive Diffusion durch die Bluthirnschranke. Es kann jedoch auch lokal im Gehirn aus Cholesterin oder aus aromatisierten Vorstufen durch das Enzym Aromatase synthetisiert werden und dort als Neurosteroid wirken. Die physiologischen Effekte können durch Aktivierung von verschiedenen Estrogenrezeptoren bedingt werden, insbesondere des Estrogen-Rezeptors-α (ERα), des Estrogen-Rezeptors-β (ERβ), and des G Protein-gekoppelten Estrogen-Rezeptors-1 (GPER/GPR30) [9].
Estrogene entwickeln ihre biologische Wirkung im zentralen Nervensystem durch genomische oder nichtgenomische zelluläre Mechanismen. Dadurch können die Neurotransmission und die Zellfunktion verändert werden. Intrazelluläre Signalkaskaden können enzymatische Reaktionen, die Leitfähigkeit von Ionenkanälen und die neuronale Erregbarkeit modifizieren [4].
Zahlreiche Gehirnareale, die in der Pathophysiologie der Migräne involviert sind, exprimieren Estrogenrezeptoren. Dies trifft insbesondere für den Hypothalamus, das Kleinhirn, das limbische System, Brückenkerne sowie das periaquäduktale Grau (Substantia grisea periaquaeductalis) zu. Estrogen-Rezeptoren werden ebenfalls in der Hirnrinde exprimiert, wodurch die Schmerzempfindlichkeit afferent und efferent moduliert werden kann. Auch das kraniale Gefäßsystem, die Dura mater sowie das Hinterhorn des Rückenmarks exprimieren Estrogen-Rezeptoren, wodurch schmerzhafte Reize moduliert werden können [4, 8, 9].
Genomweite Assoziationsstudien zeigten keine Korrelation zwischen Estrogen-Rezeptor-Polymorphismen und einem erhöhten Risiko für Migräne. Es konnte jedoch ein Single-Nukleoid-Polymorphismus im SYNE1-Gen in Assoziation mit menstrueller Migräne aufgedeckt werden [10].
Das serotoninerge System kann durch Estrogen aktiviert werden, was sich protektiv gegenüber Migräneattacken auswirken kann [11]. Estrogen kann auch die erregende Wirkung von Glutamat erhöhen. Dies kann die erhöhte Wahrscheinlichkeit für das Entstehen einer Migräneaura in Phasen hoher Estrogen-Konzentrationen erklären, wie z.B. während der Schwangerschaft oder unter der Gabe von exogenen Hormonen.
Estrogen kann das γ-Aminobuttersäure-System (GABA) modulieren, welches inhibitorisch im Nervensystem wirkt [12]. Progesteron, das hauptsächlich vom Gelbkörper der Eierstöcke produziert wird, als auch sein Metabolit Allopregnanolon können die GABA-erge Aktivität verstärken und so eine antinozizeptive Wirkung bedingen .
Estrogene können auch das endogene Opioidsystem durch erhöhte Synthese von Enkephalin modulieren [13]. Entsprechend kann ein erniedrigter Estrogen- und Progesteron-Spiegel während der späten Lutealphase mit einer reduzierten Aktivierung des Opioidsystems korreliert sein. Dies bedingt eine erhöhte Schmerzempfindlichkeit. Untersuchungen zur Schmerzempfindlichkeit während der verschiedenen Phasen des Menstruationszyklus zeigten eine erhöhte Sensibilität während der lutealen Phase, insbesondere bei Frauen, die prämenstruelle Beschwerden klagen [14]. Hohe Estrogenkonzentrationen fördern zudem die Bildung von weiteren schmerzhemmenden Neurotransmittern und Neuropeptiden, wie u.a. Neuropeptid Y, Prolaktin und Vasopressin, welche in der Entstehung von Migräne eine Rolle spielen können [4].
Oxytocin und Migräne
Das Neuropeptid Oxytocin wird im Hypothalamus gebildet. Es hat umfangreiche Effekte im zentralen Nervensystem. Insbesondere moduliert es Stimmung und Verhalten. Es beeinflusst die körpereigene Schmerzkontrolle und kann migränepräventiv wirken [4]. In Phasen erhöhter Estrogen-Konzentrationen sind auch die Spiegel von Oxytocin erhöht. Estrogen führt zu einer erhöhten Produktion von Oxytocin im Hypothalamus und weiteren Hirnarealen, insbesondere im trigeminalen Nucleus caudalis [15]. Frauen, die an menstrueller Migräne leiden, zeigen erniedrigte Schmerzschwellen während der hormonfreien Phase bei Gabe von kombinierten hormonellen Kontrazeptiva, also zum Zeitpunkt reduzierter Estrogen-Konzentrationen [16].
Die Pathophysiologie der Migräne wird mit erhöhter kortikaler nozizeptiver Aktivität im trigemino-vaskulären nozizeptiven System in Verbindung gebracht. Diese bedingt sowohl eine Vasodilatation der intrakraniellen Gefäße als auch eine meningeale Inflammation [15]. Die lokale Aktivierung der Estrogen-Rezeptoren im Trigeminusganglion soll möglicherweise zur Triggerung von Migräneattacken führen. Frauen haben mehr Estrogen-Rezeptoren im Trigeminusganglion als Männer [17]. Estrogene können durch Hemmung von Calciumkanälen der glatten Muskulatur den Gefäßtonus akut beeinflussen [18]. Auch kann die cortical spreading-depression (CSD) durch Estrogene aktiviert werden. Dabei erfolgt eine kortikale neuronale Depolarisierung, welche als charakteristisches Merkmal der Migräne mit Aura angesehen wird [19]. Hohe Spiegel von Estrogen erhöhen die Empfindlichkeit für CSD, ein Estrogenentzug reduziert die Empfindlichkeit für CSD. Dies könnte eine Erklärung dafür sein, dass Migräneattacken im menstruellen Fenster weniger häufig mit einer Aura assoziiert sind [1].
Estrogene und Calcitonin-Gene-Related-Peptide (CGRP)
Die Freisetzung von Calcitonin Gene-Related Peptide (CGRP) wird heute als ein entscheidender Schritt in der Pathophysiologie der Migräne angesehen. Durch eine Stimulation des Trigeminusganglion kann es zu einer Freisetzung von CGRP und Substanz P in die kraniale Blutzirkulation kommen [20]. CGRP aktiviert u.a. in der Dura, im Trigeminusganglion, im zervikalen Trigeminuskernkomplex, im Thalamus und im periaquaduktalen Grau nociceptive Mechanismen [20]. Sowohl die klinische Symptomatik einer Migräne als auch die Freisetzung von CGRP können durch Triptane blockiert werden [21]. CGRP-Infusionen können bei Migränepatienten eine Attacke provozieren [22]. Dies ist nicht der Fall bei gesunden Kontrollpersonen. Monoklonale Antikörper, die spezifisch auf das CGRP als Ligand (Eptinezumab, Fremanezumab und Galcanezumab) oder den CGRP-Rezeptor (Erenumab) gerichtet sind, sind mittlerweile für die vorbeugende Behandlung von episodischer und chronischer Migräne in der Versorgung verfügbar [23, 24]. Sie haben sich in kontrollierten Studien als wirksam und verträglich gezeigt.
Die CGRP-Spiegel sind bei Frauen höher als bei Männern [25]. Auch sind sie während der Schwangerschaft und bei Gabe von kombinierten hormonellen Kontrazeptiva angehoben. In der Menopause sind die Spiegel variabel [26]. CGRP-Rezeptoren und Estrogen-Rezeptoren werden in den gleichen Hirnarealen exprimiert. Estrogen kann die CGRP-Produktion in trigeminalen Neuronen modulieren. Experimentell führt die Gabe von exogenem Estrogen zu reduzierten CGRP-Spiegeln [27]. Während der Postmenopause können die CGRP-Spiegel erhöht sein, während die Estrogen-Konzentrationen reduziert sind [28].
Auch Substanz P kann als vasoaktives Neuropeptid eine neurogene Entzündung im Bereich der Meningen im Zusammenhang mit Migräne bedingen [28]. Estrogengabe kann Plasmaspiegel von Substanz P reduzieren. Zusammenfassend kann Estrogen sowohl CGRP, als auch Substanz P durch hemmende Effekte modulieren. Estrogen bedingt somit einen protektiven Mechanismus gegen die neurogene Inflammation [28]. Darüber hinaus kann Estrogen den aktivierenden Effekt von Progesteron auf CGRP und Substanz P hemmen. Dies weist darauf hin, dass die Kombination von Estrogen und Progesteron stabilisierende Wirkung auf die CGRP- und Substanz-P-Freisetzung hat [4].
Migränepatientinnen weisen erhöhte Spiegel von proinflammatorischen Cytokininen sowohl während der Migräneattacke als auch im Intervall auf [29]. Experimentelle Studien weisen darauf hin, dass Estrogene zirkulierende inflammatorische Moleküle hemmen können. Zusätzlich wirken sie protektiv gegen die prostaglandininduzierte Inflammation. Dagegen kann Estrogenentzug die Empfindlichkeit für Prostaglandine erhöhen und die Neuroinflammation durch verstärkte Freisetzung von Neuropeptiden wie CGRP, Substanz P und Neurokinin aktivieren [30].
Zusammenfassend weisen die vorliegenden Daten daraufhin, dass Estrogen für sich keinen direkten protektiven Effekt auf Migräneattacken ausübt. Jedoch kann Estrogen indirekt aktivierende und hemmende Migränefaktoren beeinflussen. In der Folge kann die Initiierung von Migräneattacken im neurovaskulären Bereich gehemmt werden. In der trigemino-vaskulären Zirkulation kann die Empfindlichkeit für Migräne verringert werden. Sind Estrogen-Konzentrationen reduziert, kann die Schwelle für Migräneattacken gesenkt werden [4, 15].
Estrogene in der Vorbeugung der menstruellen Migräne
Bei einigen Patienten können Migräneattacken ausschließlich im menstruellen Zeitfenster auftreten [1]. Die Anfälle können dabei deutlich schwerere Schmerzcharakteristika (Dauer, Intensität, Verstärkung durch körperliche Aktivität) und Begleitsymptome (Übelkeit, Erbrechen, Photo- und Phonophobie) im Vergleich zu Migräneattacken außerhalb des menstruellen Fensters aufweisen.
Die Beeinflussung der natürlichen Estrogen-Konzentrationen kann eine Möglichkeit sein, menstruell gebundene Migräneattacken vorbeugend zu behandeln. Ziel dabei ist, die hormonellen Konzentrationsfluktuationen und den Estrogenabfall während der menstruellen Blutungsphase zu reduzieren. Dies gründet auf der Beobachtung, dass die Empfindlichkeit für Migräneattacken während des perimenstruellen Fensters zwischen Tag -2 und +3 der Menstruation mit dem Hormonabfall korreliert ist [31].
Grundsätzlich stehen 2 Vorgehensweisen zur Verfügung, um Hormone in der vorbeugenden Behandlung der menstruellen Migräne einzusetzen:
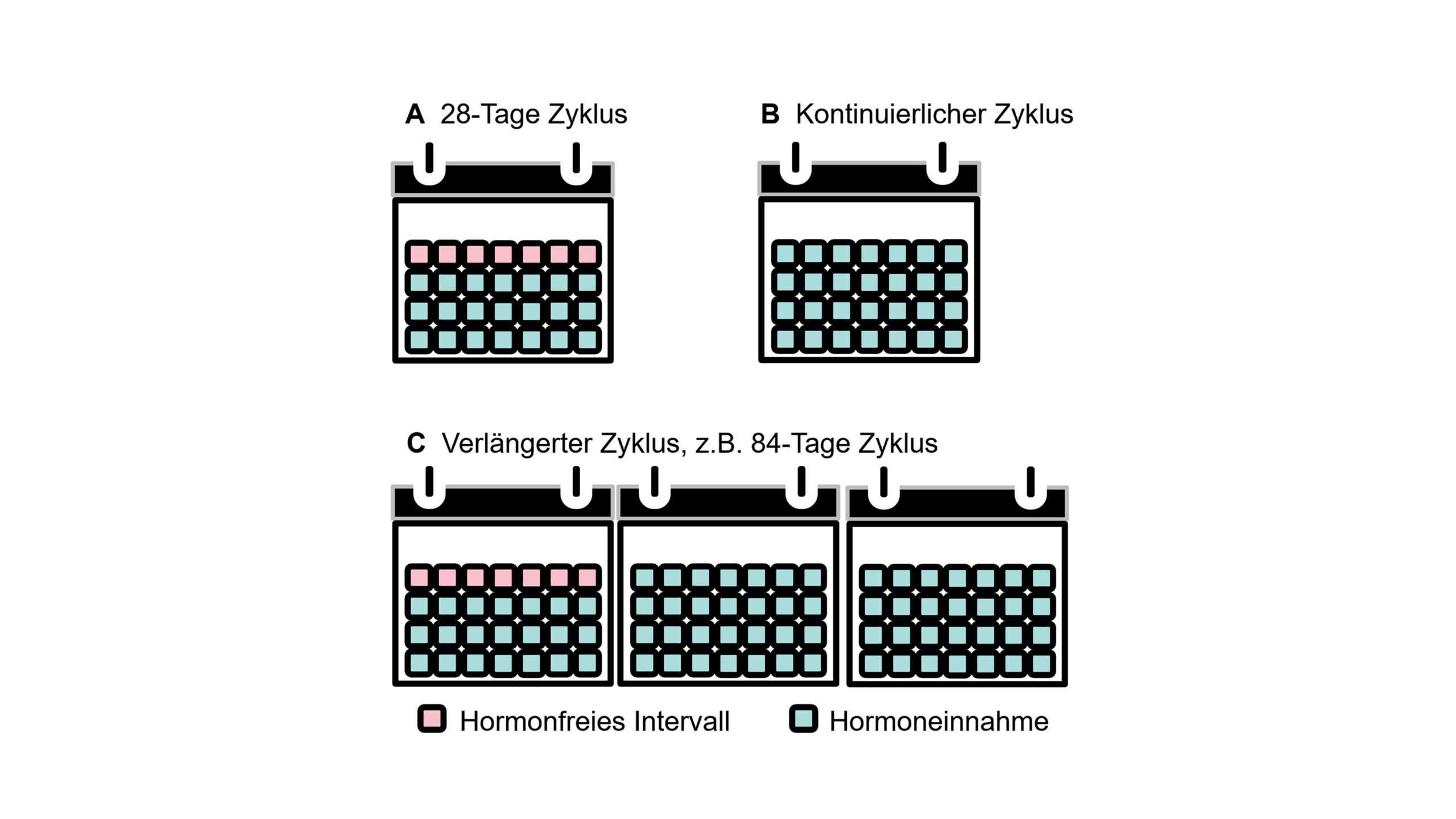
- Hormonelle Kontrazeptiva können mit unterschiedlichen Verabreichungsschemata von Ethinylestradiol je nach Dauer des hormonfreien Intervalls eingesetzt werden. Die Vorgehensweise schließen Standardschema 21/7, variable verlängerte Schemata und kontinuierliche Schemata ohne hormonfreie Intervalle ein (Abb. 2). Anwendungsoptionen schließen orale hormonelle Kontrazeptiva und Vaginalringe ein.
- Des Weiteren können auch Estrogensupplementierungen, die nicht auf Kontrazeption ausgelegt sind, eingesetzt werden. Beispiele sind transdermale Plaster, Gel-Applikationen und subkutane Implantate. Diese zielen auf den Ausgleich des Estrogenabfalls während der perimenstruellen Periode bei menstruell bedingter Migräne und reiner menstrueller Migräne ab.
Die Datenlage zum Einsatz von Hormonen in der Vorbeugung der menstruellen Migräne ist sehr begrenzt und teilweise widersprüchlich. Rationale ist, den Abfall des endogenen Estrogens bei Patienten mit reiner menstrueller Migräne bei vorhersagbarer Menstruation auszugleichen [4, 32, 33]. Andererseits sollen kontinuierliche Gaben von niedrigen Dosen physiologische Hormonfluktuationen entgegenwirken. Die kombinierte Gabe von Estrogen und Gestagenen sollen die Hormonspiegel stabilisieren und eine Kontrazeption ermöglichen [4, 32, 33]. Nachfolgend werden verschiedene Optionen zur Beeinflussung des weiblichen Hormonzyklus zur Behandlung der Migräne beschrieben.
Desogestrel (Gestagen-Monopräparat)
In vier offenen Beobachtungsstudien wurde der Effekt von Desogestrel 75 µg pro Tag bei Frauen mit Migräne mit und ohne Aura untersucht [34-37]. Es wurden Frauen untersucht, die das Medikament entweder zur Kontrazeption oder aus medizinischen Gründen einnahmen – nicht aber zur gezielten Migräneprophylaxe. Als Nebenwirkungen der Anwendung von Desogestrel traten eine Verstärkung von Kopfschmerzen, eine verlängerte Blutungszeit, Schmierblutungen und Akne auf. Demgegenüber steht nur eine begrenzte Evidenz für die Wirksamkeit von Desogestrel auf den Migräneverlauf bei Frauen mit Migräne ohne Aura oder Migräne mit Aura. Desogestrel kann in Hinblick auf das günstige kardiovaskuläre Risikoprofil sowohl bei Frauen, die an Migräne mit bzw. Migräne ohne Aura und zusätzlichen vaskulären Risikofaktoren leiden, erwogen werden.
Kombinierte orale Kontrazeptiva
Die aktuelle Studienlage für die verlängerte Einnahme von kombinierten oralen Kontrazeptiva bei Frauen mit Migräne ist begrenzt [4, 32]. Auch hier liegen nur offene Beobachtungsstudien vor, die bei Frauen durchgeführt wurden, die den Wirkstoff zur Kontrazeption oder aus medizinischen Gründen eingenommen haben – nicht zur Migräneprophylaxe. Nur in einer Studie wurden kombinierte orale Kontrazeptiva spezifisch für die Kopfschmerzvorbeugung eingesetzt [38]. Die verfügbaren Daten weisen auf einen möglichen Nutzen einer Langzeitzykluseinnahme von kombinierten hormonellen Kontrazeptiva bei Frauen mit Migräne ohne Aura hin.
Desogestrel versus erweiterte Gabe kombinierter oraler Kontrazeptiva
In offenen Beobachtungsstudien wurde der Effekt der Desogestrel-Minipille mit der verlängerten Gabe von kombinierten oralen Kontrazeptiva bei Migräne ohne Aura verglichen. In einer Studie von Morotti et al [36] fand sich kein Unterschied bezüglich der Migränetage, der Kopfschmerztage, der Kopfschmerzintensität und der Tage mit Einsatz von Triptanen. Die aktuelle Studienlage zum Vergleich der Desogestrel-Minipille mit kombinierten oralen Kontrazeptiva ist begrenzt. Die Ergebnisse der Beobachtungsstudien erlauben keine abschließenden Aussagen zur Wirksamkeit.
Kombinierte orale Kontrazeptiva mit verkürztem pillenfreiem Intervall
Für den Einsatz von kombinierten oralen Kontrazeptiva mit verkürztem pillenfreien Intervall liegen ebenfalls nur Studien mit gering eingestufter Qualität vor [4, 32]. Diese weisen sehr heterogene Schemata auf. Es gibt keine Belege für die Überlegenheit eines spezifischen Schemas im Vergleich zu anderen Optionen. Ausreichende Belege liegen nicht vor, um die Behandlung ausschließlich für die Vorbeugung von Migräne einzusetzen. Bei einigen Frauen musste die Gabe aufgrund einer Verschlechterung der Migräne vorzeitig abgesetzt werden.
Kombinierte orale Kontrazeptiva mit oraler Estrogengabe während der „pillenfreien Zeit“
Evidenz für den Einsatz von oralen kombinierten hormonellen Kontrazeptiva mit oralen Östrogen-Ersatz während der pillenfreien Zeit liegt nur aus einer einzigen Studie vor [39]. Die aktuelle Datenlage erlaubt keine Aussage zur Wirksamkeit dieses Behandlungsregimes auf den Migräneverlauf.
Kombinierte orale Kontrazeptiva mit Estradiol-Supplementierung durch ein Pflaster während der pillenfreien Zeit
In einer monozentrischen Studie zeigte sich keine signifikante Verringerung der Anzahl der Migränetage, des Schwergrad der Migräne und der Migränebegleitsymptome [40]. Unerwünschte Ereignisse im Zusammenhang mit der transdermalen Estradiol-Supplementierung waren veränderte Entzugsblutungen. Die aktuelle Datenlage erlaubt keine ausreichende Begründung für den Einsatz einer Estradiol-Supplementierung mit Pflastern zur Vorbeugung der Migräne während des pillenfreien Intervalls.
Kombinierte hormonelle Verhütungspflaster
Die Datenlage zum Einsatz von kombinierten hormonellen Verhütungspflastern ist sehr limitiert. Daten liegen nur aus einer Studie vor [41]. Die Ergebnisse dieser Studie legen einen Zusammenhang zwischen dem Hormonentzug und dem Kopfschmerzauftreten nahe. Die Kopfschmerztage waren während der Woche ohne Pflaster höher. Nach Abnahme des Pflasters nach verlängerter Behandlung stieg die Häufigkeit der Kopfschmerzen nicht an. Die aktuelle Studienlage begründet keine Evidenz für den Einsatz dieses Vorgehens.
Kombinierter hormoneller Vaginalring zur Empfängnisverhütung
Auch der Einsatz der kombinierten hormonellen Kontrazeption mit einem Vaginalring auf den Verlauf der Migräne ist sehr begrenzt [42]. Die vorliegenden Daten sind nicht ausreichend, um den Einsatz zur Vorbeugung der Migräne zu begründen [4, 32].
Transdermale Estradiol-Supplementierung mit Gel
Der Effekt der transdermalen Estradiol-Supplementation mit Gel bei prämenopausalen Patientinnen wurde in 3 Studien untersucht [43-45]. Dabei wurde Estradiol-Gel 1,5 mg für 6 bzw. 7 Tage eingesetzt. Der Effekt wurde mit der Gabe von Placebo verglichen. Die Behandlung im Rahmen der Studie erfolgte spezifisch zur Kopfschmerzvorbeugung. Schwerwiegende unerwünschte Ereignisse im Zusammenhang mit der Anwendung von Estradiol-Gel wurden nicht berichtet. Hautausschlag, Angst oder Amenorrhoe wurden als unerwünschte Nebenwirkungen dokumentiert. Aufgrund der aktuellen Studienlage ist der Einsatz von transdermalem Estradiol mit Gel zur Migränevorbeugung nicht ausreichend begründbar. Einerseits ist die Gabe von transdermalem Estradiol mit Gel einfach und in der Regel gut verträglich. Auf der anderen Seite kann bei irregulärer Menstruation die zeitliche Anwendung problematisch sein. Nachteilig kann auch die Zunahme der Migräne durch den verzögerten Östrogenentzug sein. Bedingt kann dies durch eine erhöhte Estradiol-Gabe mit zusätzlicher Estradiol-Supplementierung und verstärktem Abfall sein. Auch kann der follikuläre Anstieg von endogenem Östrogen durch die exogene Gabe gehemmt werden. Aufgrund der mangelnden Datenlage kann die Gabe von Östrogen-Gel aktuell nicht zur Vorbeugung der menstruellen Migräne empfohlen werden. Erwogen werden kann dieses Vorgehen aktuell dann, wenn alle anderen Strategien nicht ausreichend wirksam sind, um menstruelle Migräne vorzubeugen.
Transdermale Estradiol-Supplementierung durch ein Pflaster
Die Evidenz für die Anwendung der transdermalen Estradiol-Supplementierung mit einem Pflaster zur Behandlung der menstruellen Migräne ist begrenzt. Rationale für die Anwendung ist die Aufrechterhaltung von stabilen Estradiol-Konzentrationen vor Beginn des Blutungseintritts [41]. Aktuell liegen keine Daten vor, die die Wirksamkeit einer Estradiol-Supplementierung mit Pflastern auf den Migräneverlauf belegen.
Transdermale Östrogen-Supplementierung mit Pflaster bei Frauen mit pharmakologisch induzierter Menopause
Der Einsatz von transdermalem Estradiol mit Pflaster bei Frauen mit einer pharmakologisch induzierten Menopause ist aufgrund der aktuellen Datenlage nicht ausreichend begründbar. Während der pharmakologisch induzierten Menopause ist das Risiko für Osteoporose, Depressionen, Hitzewallungen, Reizbarkeit, verminderter Libido und vaginaler Trockenheit erhöht. Dieses kann durch eine Östrogen-Ergänzungstherapie reduziert werden [46]. Die aktuelle Studienlage ist für einen begründeten Einsatz zur Migräneprophylaxe nicht ausreichend.
Subkutanes Östrogen-Implantat mit zyklischem Progestogen
In einer offenen Beobachtungsstudie wurde der Einsatz von einem subkutanen Östrogen-Implantat mit zyklischem Progestogen untersucht [47]. Die Datenlage erlaubt keine ausreichenden Schlussfolgerungen für einen möglichen Einsatz zur Vorbeugung der Migräne.
Add-Back-Therapie
Untersucht wurde der Kopfschmerzverlauf bei Frauen, die ein Gonadotropin-Releasing-Hormon (GnRH)-Analogon, einem Auslöser der vorübergehenden iatrogenen Menopause, plus transdermalen Estrogen-Pflaster, allein oder in Kombination mit einem Gestagen erhielten (Add-Back-Therapie) [48]. Es zeigte sich eine Reduktion der Kopfschmerzschwere, jedoch nicht der Kopfschmerzfrequenz. Diese Studie gibt Hinweise darauf, dass die Reduktion von Hormonfluktuationen in der Vorbeugung von Migräne außerhalb des menstruellen Fensters nützlich sein könnte.
Phytoestrogene
Phytoestrogene sind sekundäre Pflanzenstoffe wie Isoflavone und Lignane. Sie sind keine Estrogene im chemischen Sinne, besitzen jedoch strukturelle Ähnlichkeit mit diesen. Dadurch wird eine schwache estrogene oder auch antiestrogene Wirkung erzielt. Die bekanntesten Phytoestrogene sind die Isoflavone Genistein, Daidzein und Coumestrol. Insbesondere Genistein und Daidzein werden zur Linderung von Hitzewallungen und anderen Wechseljahresbeschwerden und auch bei menstrueller Migräne eingesetzt. In einer offenen Studie über 10 Tage im menstruellen Zeitraum von -7 bis +3 zeigte sich eine mittlere Reduktion der Kopfschmerztage um 62% [49]. Die Hälfte der Patienten berichtete über ein Ausbleiben von Übelkeit und Erbrechen in Verbindung mit der Migräne. Eine randomisierte kontrollierte Studie bestätigte den Effekt über 24 Wochen bei einer Behandlung mit 60 mg Soja-Isoflavone, 100 mg Dong Quai und 50 mg Traubensilberkerze [50]. Hier zeigte sich eine hochsignifikante Reduktion der menstruell bedingten Migräne, der Einnahme von Akutmedikation sowie der Kopfschmerzschwere. Phytoestrogene könnten daher möglicherweise eine Option für Frauen sein, die Hormonbehandlungen nicht einnehmen wollen oder aufgrund Kontraindikation diese nicht einsetzen können, wie z.B. bei bedeutsamem kardiovaskulärem Risikoprofil.
Weitere Hormonbehandlungen
In Studien zum Einsatz von kontrazeptiven Optionen zur Kopfschmerzvorbeugung zeigte sich, dass die Induktion einer Amenorrhoe mit einer signifikanten Linderung der Kopfschmerzen einhergeht [4, 32]. Therapien mit Progesteron-Mono-Präparaten haben ein erniedrigtes Risiko für kardiovaskuläre Ereignisse oder Komplikationen als Estrogene [4, 30, 33]. Auch diese können effektiv in der Vorbeugung der Migräne mit Aura sein. Aufgrund der kontinuierlichen Einnahme finden zyklustypische Schwankungen der weiblichen Geschlechtshormone sowie ein akuter Estrogenentzug nicht statt.
Testosteron zeigt in präklinischen Studien eine Suppression der kortikalen Spreading-Depression [51]. Die subkutane Applikation von Testosteron-Implantaten kann bei Patienten mit einer Androgeninsuffizienz die Schwere von Kopfschmerzen reduzieren. Nach Ovarektomie mit Androgeninsuffizienz berichten Frauen einen Anstieg der Migränefrequenz im Vergleich zu Frauen, die in eine natürliche Menopause eintreten [52].
Unterziehen sich Frauen einer Hormonersatztherapie in den Wechseljahren, weisen sie eine Verschlechterung ihrer Kopfschmerzen auf [53]. Dies ist wahrscheinlich durch eine unregelmäßige Freisetzung von Estrogenen bedingt. Möglicherweise kann die Hormonersatztherapie in dieser Situation den Estrogen-Entzug stabilisieren. Dabei sollte die geringstmögliche Dosis gewählt werden, welche die Symptome während der Menopause kontrollieren kann, um kardiovaskuläre Nebenwirkungen, insbesondere bei Migräne mit Aura, zu vermeiden. Die transdermale Applikation von Estrogen oder der Einsatz von kontinuierlichen kombinierten Schemata wie die Hormonersatztherapie, die Blutungen vermeiden, ist möglicherweise die beste Vorgehensweise, um der Migräne in dieser Situation vorzubeugen.
Topiramat, menstruelle Migräne und Kontrazeption
Topiramat ist zur vorbeugenden Behandlung der Migräne zugelassen und wird auch bei menstrueller Migräne eingesetzt. Dabei sollte bei Topiramat-Tagesdosen oberhalb von 200 mg die Möglichkeit einer verminderten kontrazeptiven Wirksamkeit und von vermehrten Durchbruchblutungen berücksichtigt werden, wenn Patientinnen eine orale Kontrazeption mit kombinierten hormonellen Kontrazeptiva durchführen [54]. Frauen, die estrogenhaltige Kontrazeptiva einnehmen sollten aufgefordert werden, jede Änderung ihrer Menstruationsblutung dem behandelnden Arzt mitzuteilen. Die kontrazeptive Wirksamkeit kann durch die Behandlung mit Topiramat auch bei Abwesenheit von Durchbruchblutungen vermindert sein [55].
CGRP-mAK und menstruelle Migräne
Aktuell gibt es keine spezifische vorbeugende Behandlung für die Indikation menstruelle Migräne. In letzter Zeit wurde der Einsatz monoklonaler Antikörper gegen CGRP oder den CGRP-Rezeptor zur Behandlung der menstruellen Migräne untersucht. Diese haben durch ihre lange Halbwertzeit den Vorteil, dass sie gerade im Langzeitverlauf nur monatlich oder im Abstand von 3 Monaten appliziert werden müssen. Mittlerweile sind in Deutschland Galcanezumab, Erenumab, Eptinezumab und Fremanezumab zur vorbeugenden Behandlung der Migräne verfügbar. In einer Studie mit Erenumab [56] wurde der Verlauf der menstruellen Migräne in einer Gruppe, die auf Erenumab ansprach und in einer Gruppe, die nicht auf Erenumab ansprach, verglichen. Es zeigte sich, dass in beiden Gruppen die Kopfschmerzhäufigkeit innerhalb des menstruellen Fensters größer war, als außerhalb des menstruellen Fensters. Dies bedeutet, dass auch bei Behandlung mit Erenumab Migräne im menstruellen Fenster häufiger auftritt als außerhalb des menstruellen Fensters. In einer weiteren Studie wurde die Wirksamkeit von Erenumab in der Vorbeugung der menstruellen Migräne analysiert [57]. Die monatlichen Migränetage schlossen sowohl perimenstruelle und intermenstruelle Migräneattacken ein. Erenumab 70 mg und 140 mg reduzierten signifikant die Häufigkeit der Migränetage pro Monat im Vergleich zu Placebo. Die Daten belegen die Wirksamkeit von Erenumab zur Vorbeugung der menstruellen Migräne [57].
Kardiovaskuläres Risiko
Migränepatienten zeigen ein etwa doppelt so hohes Risiko für Schlaganfall als gesunde Kontrollpersonen. Dies gilt insbesondere für Migräne mit Aura. Migräne ist ein ebenso bedeutsamer Risikofaktor für Schlaganfall wie Thrombophilie, offenes Foramen ovale, arterielle Dissektion, Rauchen und Übergewicht [4, 30, 32, 33, 58-60].
Estrogene verbessern den endothelialabhängigen Blutfluss und Lipidprofile. Sie haben jedoch auch prothrombotische und proinflammatorische Wirkungen. Diese können besonders bei Patientinnen relevant sein, bei denen ein erhöhtes Risiko für Schlaganfall und andere vaskuläre Ereignisse wie Herzinfarkt oder tiefe Venenthrombose besteht. Die Gabe von kombinierten oralen Kontrazeptiva kann insbesondere mit einem früheren Eintreten eines Schlaganfalls verbunden sein [4, 32, 61, 62].
Grundsätzlich muss die Präsenz von zwei unabhängigen Risikofaktoren für Schlaganfall sorgfältig abgewogen werden. Studien zeigen, dass Frauen, bei denen eine Migräne besteht und die zusätzlich kombinierte hormonelle Kontrazeptiva erhalten, ein erhöhtes Risiko für Schlaganfall von 2.1-13.9 aufweisen [33, 61]. Das Schlaganfallrisiko ist korreliert mit der Estrogendosis. Experten-Leitlinien der European Headache Federation (EHF) und der European Society of Contraception and Reproductive Health (ESCRH) [32, 33], der Deutschen Gesellschaft für Neurologie (DGN) in Zusammenarbeit mit der Deutschen Migräne- und Kopfschmerzgesellschaft [63] sowie der Deutsche Gesellschaft für Gynäkologie und Geburtshilfe [62] empfehlen daher den Einsatz von kombinierten hormonellen Kontrazeptiva nicht für Patientinnen, die an einer Migräne mit Aura leiden. Patientinnen mit einer Migräne ohne Aura sollten bei Vorliegen von weiteren vaskulären Risikofaktoren kombinierte hormonelle Kontrazeptiva nicht anwenden. Alternativ können Kontrazeptiva, die ausschließlich Gestagen enthalten, oder kombinierte orale Kontrazeptiva mit Estrogendosierungen niedriger als 35 µg erwogen werden.
Zur Vorbeugung der menstruellen Migräne können verlängerte Zyklusschemata, Anwendungen mit stabilen Hormonspiegel wie z.B. transvaginale Administration oder transdermale Estradiol-Supplementierung eingesetzt werden. Auch können niedrige Dosierungen von Estrogen für diese Patienten erwogen werden. Die bisherige Datenlage ist jedoch weiterhin nicht ausreichend, um verlässliche Aussagen über die Wirksamkeit und Verträglichkeit zu machen. Auch wenn die Monotherapie mit Gestagen das sicherste vaskuläre Risikoprofil aufweist, können dennoch Nebenwirkungen wie Durchbruchblutungen beobachtet werden.
Insgesamt zeigen die Studien, dass die Behandlung mit Estrogen die Behandlung ist, die am ehesten effektiv und verträglich eingesetzt werden kann. Zukünftig werden auch Studien zur Wirksamkeit und Verträglichkeit von natürlichem Estrogen bedeutsam sein. Ein kurzes hormonfreies Intervall ist wahrscheinlich am effektivsten zur Vermeidung eines Estrogen-Abfalls mit potentieller Auslösung einer Migräneattacke. Allerdings sind zukünftig weitere kontrollierte Studien erforderlich, um hier verlässliche Aussagen machen zu können.
Aktuelle Leitlinienempfehlungen zur Prophylaxe der menstruellen Migräne
Die aktuelle Leitlinie der Deutschen Gesellschaft für Neurologie (DGN) in Zusammenarbeit mit der Deutschen Migräne- und Kopfschmerzgesellschaft [63] aus dem Jahre 2022 empfiehlt zur Kurzzeitprophylaxe der menstruellen Migräne das langwirksame NSAR Naproxen (Halbwertszeit 12-15 h) oder ein Triptan mit langer Halbwertzeit. Die Wirkstoffe sollen 2 Tage vor Einsetzen der erwarteten Menstruation über einen Zeitraum von 5-6 Tagen gegeben werden. Des Weiteren kann die kontinuierliche Gabe eines kombinierten oralen Kontrazeptivums als vorbeugende Maßnahme erwogen werden. Ebenfalls kann die Gabe von Desogestrel zur Prophylaxe der menstruellen Migräne in Betracht gezogen werden.
Es liegen placebokontrollierte Studien zum Einsatz von Frovatriptan 2,5 mg 1x, 2x oder 3x pro Tag, Zolmitriptan 2,5 mg 2x oder 3x pro Tag, Naratriptan 2x pro Tag 1 mg bzw. 2,5 mg und für Naproxen 2×550 mg pro Tag vor. Die Gabe soll 2 Tage vor dem erwarteten Einsetzen der Migräneattacke im menstruellen Fenster über insgesamt 6-7 Tage erfolgen. Das Risiko für die Entwicklung eines Medikamentenübergebrauchskopfschmerzes bei Anwendung von Naproxen oder einem Triptan zur Kurzzeitprophylaxe bei der menstruellen Migräne wird als gering angesehen, wenn ansonsten nur wenig Akutmedikamente verwendet werden.
Die aktuelle Leitlinie empfiehlt nicht die perkutane Estrogengabe. Grund ist ein verzögertes Auftreten der Migräneattacke nach Absetzen des Estrogengels. Die perkutane Estrogen- Supplementierung soll nur dann erwogen werden, wenn andere vorbeugende Maßnahmen nicht wirksam sind. Voraussetzungen für dieses Vorgehen ist ein regelmäßiger Zyklus, um den Zeitpunkt der Applikation festzulegen. Die zusätzliche perkutane Estrogen-Supplementierung im pillenfreien Intervall wird für die Migräneprophylaxe der menstruellen Migräne aufgrund mangelnder Datenlage nicht empfohlen.
Die kontinuierliche Gabe eines kombinieren oralen Kontrazeptivums kann nach der aktuellen Leitlinie als vorbeugende Maßnahme in Betracht gezogen werden. Ziel ist, die Zahl der Zyklen und die dadurch getriggerten Migräneattacken zu reduzieren. Die kontinuierliche Anwendung über einen Zeitraum von bis zu 2 Jahren wird als sicher angesehen. Die Leitlinie weist darauf hin, dass diese vorbeugende Behandlung von Kopfschmerzen und von Migräneattacken außerhalb des menstruellen Fensters bislang nur in offenen unkontrollierten Studien untersucht worden ist. Da kombinierte orale Kontrazeptiva das Risiko für einen Schlaganfall signifikant erhöhen können und die Migräne mit Aura selbst ein Risikofaktor für Schlaganfälle darstellt, muss individuell das kardiovaskuläre Risikoprofil der Patientinnen berücksichtigt werden. Der kontinuierliche Einsatz von kombinierten oralen Kontrazeptiva ist nach der Leitlinie bei Patientinnen mit einer ausschließlichen Migräne ohne Aura und ohne weitere kardiovaskuläre Risikofaktoren am wenigsten bedenklich. Anderenfalls ist die Indikation streng zu stellen, eine entsprechende Aufklärung der Patientinnen ist vorzunehmen und das Vorgehen im Sinne einer Einzelfallentscheidung zu treffen. Kombinierte orale Kontrazeptiva mit geringem Estrogen-Anteil sollten grundsätzlich vorgezogen werden. Eine Kontraindikation für die Gabe von kombinierten oralen Kontrazeptiva ist eine hochaktive Migräne mit Aura bei Patientinnen mit erhöhtem vaskulärem Risikoprofil.
Auf ausreichende Kontrazeption muss auch bei verschiedenen vorbeugenden Therapien der Migräne geachtet werden. Dies gilt insbesondere für die Behandlung mit monoklonalen Antikörpern gegen CGRP oder den CGRP-Rezeptor, Botulinumtoxin, Flunarizin, Topiramat und Valproat.
Hormonelle Kontrazeptiva, Schlaganfallrisiko und Migräne in der Praxis
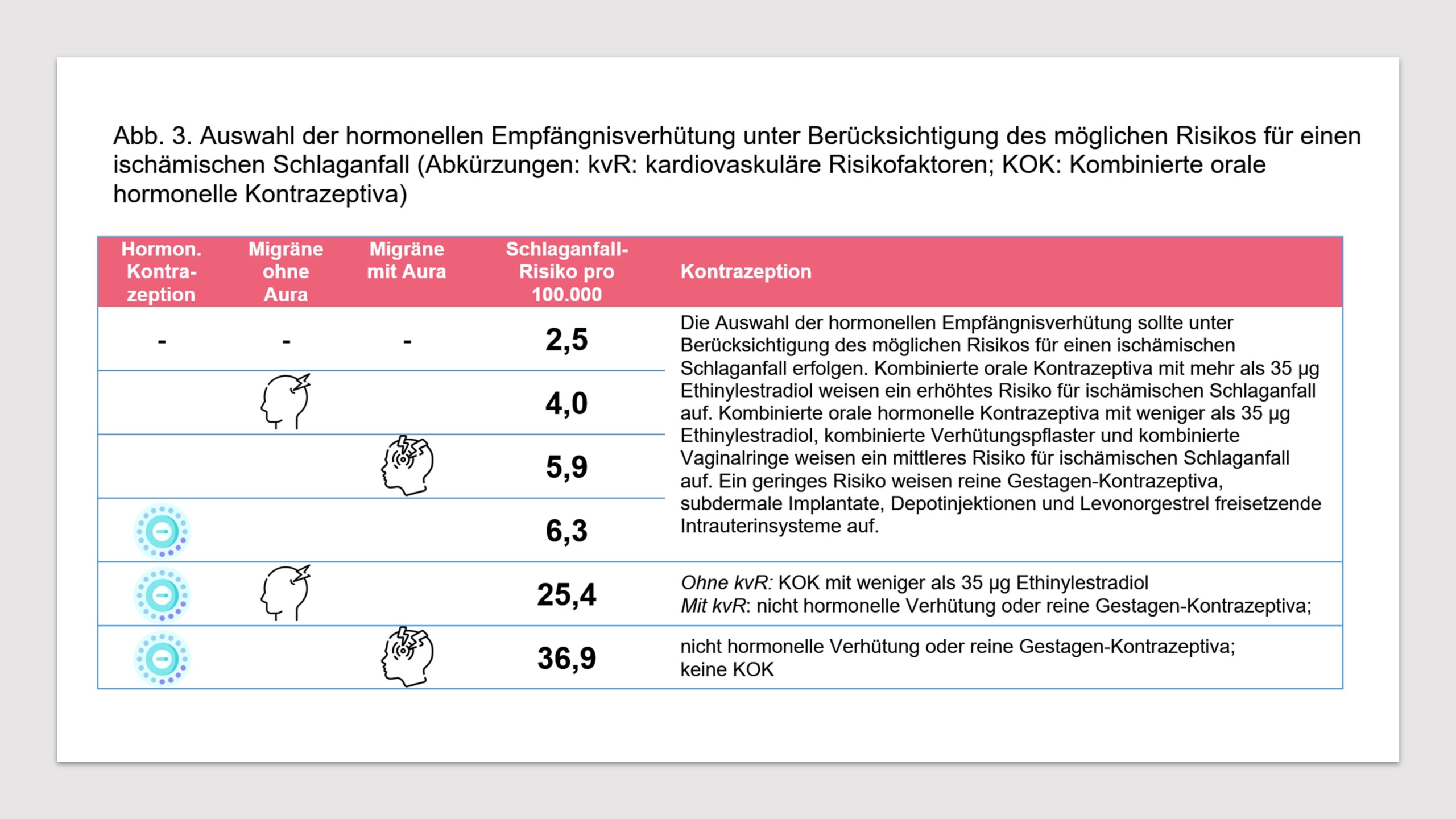
Migräne ist ein Risikofaktor für Schlaganfall und andere vaskuläre Ereignisse. Es besteht umfangreiche Evidenz, dass ein erhöhtes Risiko für ischämische Schlaganfälle sowohl mit der Migräne ohne Aura als auch mit der Migräne mit Aura assoziiert ist [4, 30, 32, 33, 58-60]. Da auch das Schlaganfallrisiko bei Einsatz von kombinierten hormonellen Kontrazeptiva erhöht sein kann [4, 32, 61], ist die Frage relevant, ob das gleichzeitige Bestehen einer Migräne und die Einnahme von kombinierten hormonellen Kontrazeptiva das Schlaganfallrisiko weiter erhöhen kann. In einem Konsensus-Statement analysieren die European Headache Federation (EHF) und die European Society of Contraception and Reproductive Health (ESCRH) diese Frage [33]. Das absolute Risiko für ischämische Schlaganfälle bei Frauen, die keine hormonelle Kontrazeption nutzen, beträgt 2,5/100.000 pro Jahr. Das gleiche Risiko beträgt für Frauen, die hormonelle Kontrazeptiva einsetzen 6,3/100.000. Leiden die Frauen an einer Migräne mit Aura, beträgt das Risiko ohne Einnahme von hormonellen Kontrazeptiva für einen ischämischen Schlaganfall 5,9/100.000 pro Jahr. Das Risiko für einen ischämischen Schlaganfall beträgt bei Bestehen einer Migräne mit Aura und Nutzung von hormonellen Kontrazeptiva 36,9/100.000 pro Jahr. Betrachtet man Frauen, die an einer Migräne ohne Aura leiden, beträgt das Risiko für ischämische Schlaganfälle 4,0/100.000 pro Jahr. Werden in dieser Gruppe hormonelle Kontrazeptiva eingesetzt, beträgt das Risiko 25,4/100.000 pro Jahr (s. Abb. 3).
Aus den Daten leitet die European Headache Federation (EHF) und die European Society of Contraception and Reproductive Health (ESCRH) folgenden Expertenkonsens ab [33]:
- Streben Frauen eine hormonelle Empfängnisverhütung an, wird eine klinische Untersuchung empfohlen, um zu analysieren, ob eine Migräne mit oder eine Migräne ohne Aura besteht. Zusätzlich soll die Migränehäufigkeit (Kopfschmerztage pro Monat) sowie die Ermittlung von vaskulären Risikofaktoren vor Verschreibung kombinierter hormoneller Kontrazeptiva erfolgen.
- Frauen, die hormonell verhüten wollen, wird die Nutzung eines speziellen Instruments zur Diagnose der Migräne und ihrer Subtypen empfohlen. Dazu können Fragebögen oder auch digitale Optionen wie die Migräne-App (unter diesem Namen in den App-Stores kostenlos downloadbar) eingesetzt werden.
- Die Auswahl der hormonellen Empfängnisverhütung sollte unter Berücksichtigung des möglichen Risikos für einen ischämischen Schlaganfall erfolgen. Kombinierte orale Kontrazeptiva mit mehr als 35 µg Ethinylestradiol weisen ein erhöhtes Risiko für ischämischen Schlaganfall auf. Kombinierte orale hormonelle Kontrazeptiva mit weniger als 35 µg Ethinylestradiol, kombinierte Verhütungspflaster und kombinierte Vaginalringe weisen ein mittleres Risiko für ischämischen Schlaganfall auf. Ein geringes Risiko weisen reine Gestagen-Kontrazeptiva, subdermale Implantate, Depotinjektionen und Levonorgestrel freisetzende Intrauterinsysteme auf.
- Frauen, bei denen eine Migräne mit Aura besteht und die eine hormonelle Empfängnisverhütung anstreben, wird von der Verordnung von kombinierten hormonellen Verhütungsmitteln abgeraten.
- Frauen, die an Migräne mit Aura leiden und eine Verhütung anstreben, werden nicht hormonelle Verhütungsmethoden (Kondome, kupferhaltige Intrauterinpessare oder reine Gestagen-Kontrazeptiva) als bevorzugte Option empfohlen. Besteht eine Migräne mit Aura und werden bereits kombinierte hormonelle Kontrazeptiva zur Empfängnisverhütung verwendet, wird eine Umstellung auf nicht hormonelle Verhütungsmittel oder reine Gestagen-Kontrazeptiva empfohlen.
- Bei Frauen, die an Migräne ohne Aura leiden und die eine hormonelle Empfängnisverhütung anstreben, bei denen jedoch zusätzliche Risikofaktoren vorliegen (Rauchen, arterielle Hypertonie, Übergewicht, Herzkreislauferkrankungen, tiefe Venenthrombose oder Lungenembolie in der Vorgeschichte) wird eine nicht hormonelle Verhütung oder reine Gestagen-Kontrazeptiva als bevorzugte Option empfohlen.
- Bei Frauen, die an einer Migräne ohne Aura leiden und hormonelle Verhütungsmittel anwenden und keine zusätzlichen Risikofaktoren aufweisen, wird die Verwendung von kombinierten hormonellen Kontrazeptiva mit einer Dosis von weniger als 35 µg Ethinylestradiol zur Empfängnisverhütung empfohlen. Gleichzeitig sollte eine Verlaufskontrolle der Migränehäufigkeit und der Migränecharakteristika erfolgen.
- Leiden Frauen an einer Migräne mit Aura oder an einer Migräne ohne Aura und bei denen aufgrund eines polyzystischen Ovarialsyndroms oder einer Endometriose eine Hormonbehandlung erforderlich ist wird empfohlen, eine Hormonbehandlung mit reinen Gestagenen oder kombinierte hormonellen Kontrazeptiva nach klinischen Gesichtspunkten einzusetzen.
- Wenn Frauen eine Empfängnisverhütung mit kombinierten hormonellen Kontrazeptiva neu beginnen und dabei eine neuauftretende Migräne mit Aura entwickeln oder bei denen eine Migräne ohne Aura im engen zeitlichen Zusammenhang mit dem Beginn der Einnahme des hormonellen Kontrazeptivums erstmalig auftritt, wird eine Umstellung auf nicht hormonelle Verhütungsmittel oder reine Gestagen-Kontrazeptiva empfohlen.
- Benötigen Frauen, die an einer Migräne mit oder ohne Aura leiden eine Notfallverhütung, wird die Verwendung von Levonorgestrel 1,5 mg oral, Ulipristalacetat 30 mg oral oder ein kupferhaltiges Intrauterinpessar empfohlen.
- Beginnen Frauen mit einer Migräne mit oder ohne Aura mit einer hormonellen Empfängnisverhütung, sind spezifische Tests wie z.B. ein Thrombophilie-Screening, Untersuchung auf offenes Foramen ovale oder bildgebende Verfahren für die Entscheidung für eine hormonelle Kontrazeption nicht relevant, es sei denn, die Anamnese oder die Befunde erfordern aufgrund spezifischer Hinweise entsprechende Untersuchungen.
- Bei Frauen mit nicht migränebedingten Kopfschmerzen, die eine hormonelle Verhütung anstreben, kann jedes niedrigdosierte hormonelle Kontrazeptivum eingesetzt werden.
Insgesamt ist die Evidenz zum Zusammenhang zwischen ischämischen Schlaganfall und dem Einsatz von hormonellen Kontrazeptiva limitiert. Im Wesentlichen liegen nur unkontrollierte Beobachtungsstudien vor. Zukünftig müssen weitere Studien durchgeführt werden, um das mögliche Risiko von hormonellen Kontrazeptiva bei Frauen mit Migräne näher zu bestimmen. Gleichwohl zeigen die bisherigen Daten ein erhöhtes Risiko für ischämischen Schlaganfall im Zusammenhang mit der Einnahme von hormonellen Kontrazeptiva bei Frauen mit Migräne. In dieser Situation ist es erforderlich, dass Sicherheitsaspekte beim Einsatz besonders beachtet werden. Auch wenn das Risiko für einen Schlaganfall absolut nicht sehr hoch ist, kann ein Schlaganfall jedoch katastrophale Folgen für individuelle Personen und deren Angehörige resultierten lassen. Aus diesen Gründen sollte bei entsprechendem erhöhtem Risiko auf Alternativen in der Kontrazeption zurückgegriffen werden.
Literatur
- Headache Classification Committee of the International Headache Society (IHS), The International Classification of Headache Disorders ICHD-3, 3rd edition. Cephalalgia, 2018. 38(1): p. 1-211.
- Classification and diagnostic criteria for headache disorders, cranial neuralgias and facial pain. Headache Classification Committee of the International Headache Society. Cephalalgia, 1988. 8 Suppl 7: p. 1-96.
- The International Classification of Headache Disorders: 2nd edition. Cephalalgia, 2004. 24 Suppl 1: p. 9-160.
- Nappi, R.E., et al., Role of Estrogens in Menstrual Migraine. Cells, 2022. 11(8).
- Russell, M.B., Genetics of menstrual migraine: the epidemiological evidence. Curr Pain Headache Rep, 2010. 14(5): p. 385-8.
- Somerville, B.W., The role of estradiol withdrawal in the etiology of menstrual migraine. Neurology, 1972. 22(4): p. 355-65.
- Pavlović, J.M., et al., Sex hormones in women with and without migraine. Neurology, 2016. 87(1): p. 49.
- Cornil, C.A., G.F. Ball, and J. Balthazart, Functional significance of the rapid regulation of brain estrogen action: where do the estrogens come from? Brain Res, 2006. 1126(1): p. 2-26.
- Boese, A.C., et al., Sex differences in vascular physiology and pathophysiology: estrogen and androgen signaling in health and disease. Am J Physiol Heart Circ Physiol, 2017. 313(3): p. H524-h545.
- Rodriguez-Acevedo, A.J., et al., Genetic association and gene expression studies suggest that genetic variants in the SYNE1 and TNF genes are related to menstrual migraine. J Headache Pain, 2014. 15(1): p. 62.
- Vetvik, K.G. and E.A. MacGregor, Menstrual migraine: a distinct disorder needing greater recognition. Lancet Neurol, 2021. 20(4): p. 304-315.
- Shughrue, P.J. and I. Merchenthaler, Estrogen is more than just a „sex hormone“: novel sites for estrogen action in the hippocampus and cerebral cortex. Front Neuroendocrinol, 2000. 21(1): p. 95-101.
- Facchinetti, F., et al., Neuroendocrine evaluation of central opiate activity in primary headache disorders. Pain, 1988. 34(1): p. 29-33.
- Tassorelli, C., et al., Changes in nociceptive flexion reflex threshold across the menstrual cycle in healthy women. Psychosom Med, 2002. 64(4): p. 621-6.
- Krause, D.N., et al., Hormonal influences in migraine – interactions of oestrogen, oxytocin and CGRP. Nat Rev Neurol, 2021. 17(10): p. 621-633.
- De Icco, R., et al., Modulation of nociceptive threshold by combined hormonal contraceptives in women with oestrogen-withdrawal migraine attacks: a pilot study. J Headache Pain, 2016. 17(1): p. 70.
- Warfvinge, K., et al., Estrogen receptors α, β and GPER in the CNS and trigeminal system – molecular and functional aspects. J Headache Pain, 2020. 21(1): p. 131.
- Kitazawa, T., et al., Non-genomic mechanism of 17 beta-oestradiol-induced inhibition of contraction in mammalian vascular smooth muscle. J Physiol, 1997. 499 ( Pt 2)(Pt 2): p. 497-511.
- Somjen, G.G., Mechanisms of spreading depression and hypoxic spreading depression-like depolarization. Physiol Rev, 2001. 81(3): p. 1065-96.
- Edvinsson, L., et al., CGRP as the target of new migraine therapies – successful translation from bench to clinic. Nat Rev Neurol, 2018. 14(6): p. 338-350.
- Knight, Y.E., L. Edvinsson, and P.J. Goadsby, 4991W93 inhibits release of calcitonin gene-related peptide in the cat but only at doses with 5HT(1B/1D) receptor agonist activity? Neuropharmacology, 2001. 40(4): p. 520-5.
- Ashina, M., Migraine. N Engl J Med, 2020. 383(19): p. 1866-1876.
- Forbes, R.B., M. McCarron, and C.R. Cardwell, Efficacy and Contextual (Placebo) Effects of CGRP Antibodies for Migraine: Systematic Review and Meta-analysis. Headache, 2020. 60(8): p. 1542-1557.
- Drellia, K., et al., Anti-CGRP monoclonal antibodies for migraine prevention: A systematic review and likelihood to help or harm analysis. Cephalalgia, 2021. 41(7): p. 851-864.
- Valdemarsson, S., et al., Hormonal influence on calcitonin gene-related peptide in man: effects of sex difference and contraceptive pills. Scand J Clin Lab Invest, 1990. 50(4): p. 385-8.
- Gupta, P., et al., Effects of menopausal status on circulating calcitonin gene-related peptide and adipokines: implications for insulin resistance and cardiovascular risks. Climacteric, 2008. 11(5): p. 364-72.
- Aggarwal, M., V. Puri, and S. Puri, Effects of estrogen on the serotonergic system and calcitonin gene-related peptide in trigeminal ganglia of rats. Ann Neurosci, 2012. 19(4): p. 151-7.
- Cetinkaya, A., et al., Effects of estrogen and progesterone on the neurogenic inflammatory neuropeptides: implications for gender differences in migraine. Exp Brain Res, 2020. 238(11): p. 2625-2639.
- Yamanaka, G., et al., Role of Neuroinflammation and Blood-Brain Barrier Permutability on Migraine. Int J Mol Sci, 2021. 22(16).
- Cupini, L.M., I. Corbelli, and P. Sarchelli, Menstrual migraine: what it is and does it matter? J Neurol, 2021. 268(7): p. 2355-2363.
- MacGregor, E.A., et al., Incidence of migraine relative to menstrual cycle phases of rising and falling estrogen. Neurology, 2006. 67(12): p. 2154-8.
- Sacco, S., et al., Effect of exogenous estrogens and progestogens on the course of migraine during reproductive age: a consensus statement by the European Headache Federation (EHF) and the European Society of Contraception and Reproductive Health (ESCRH). J Headache Pain, 2018. 19(1): p. 76.
- Sacco, S., et al., Hormonal contraceptives and risk of ischemic stroke in women with migraine: a consensus statement from the European Headache Federation (EHF) and the European Society of Contraception and Reproductive Health (ESC). J Headache Pain, 2017. 18(1): p. 108.
- Merki-Feld, G.S., et al., Improvement of migraine with change from combined hormonal contraceptives to progestin-only contraception with desogestrel: How strong is the effect of taking women off combined contraceptives? J Obstet Gynaecol, 2017. 37(3): p. 338-341.
- Morotti, M., et al., Progestogen-only contraceptive pill compared with combined oral contraceptive in the treatment of pain symptoms caused by endometriosis in patients with migraine without aura. Eur J Obstet Gynecol Reprod Biol, 2014. 179: p. 63-8.
- Morotti, M., et al., Progestin-only contraception compared with extended combined oral contraceptive in women with migraine without aura: a retrospective pilot study. Eur J Obstet Gynecol Reprod Biol, 2014. 183: p. 178-82.
- Nappi, R.E., et al., Effects of an estrogen-free, desogestrel-containing oral contraceptive in women with migraine with aura: a prospective diary-based pilot study. Contraception, 2011. 83(3): p. 223-8.
- Coffee, A.L., et al., Extended cycle combined oral contraceptives and prophylactic frovatriptan during the hormone-free interval in women with menstrual-related migraines. J Womens Health (Larchmt), 2014. 23(4): p. 310-7.
- Calhoun, A.H., A novel specific prophylaxis for menstrual-associated migraine. South Med J, 2004. 97(9): p. 819-22.
- Macgregor, E.A. and A. Hackshaw, Prevention of migraine in the pill-free interval of combined oral contraceptives: a double-blind, placebo-controlled pilot study using natural oestrogen supplements. J Fam Plann Reprod Health Care, 2002. 28(1): p. 27-31.
- LaGuardia, K.D., et al., Suppression of estrogen-withdrawal headache with extended transdermal contraception. Fertil Steril, 2005. 83(6): p. 1875-7.
- Calhoun, A., S. Ford, and A. Pruitt, The impact of extended-cycle vaginal ring contraception on migraine aura: a retrospective case series. Headache, 2012. 52(8): p. 1246-53.
- de Lignières, B., et al., Prevention of menstrual migraine by percutaneous oestradiol. Br Med J (Clin Res Ed), 1986. 293(6561): p. 1540.
- Dennerstein, L., et al., Menstrual migraine: a double-blind trial of percutaneous estradiol. Gynecol Endocrinol, 1988. 2(2): p. 113-20.
- MacGregor, E.A., et al., Prevention of menstrual attacks of migraine: a double-blind placebo-controlled crossover study. Neurology, 2006. 67(12): p. 2159-63.
- Martin, V., et al., Medical oophorectomy with and without estrogen add-back therapy in the prevention of migraine headache. Headache, 2003. 43(4): p. 309-21.
- Magos, A.L., K.J. Zilkha, and J.W. Studd, Treatment of menstrual migraine by oestradiol implants. J Neurol Neurosurg Psychiatry, 1983. 46(11): p. 1044-6.
- Murray, S.C. and K.N. Muse, Effective treatment of severe menstrual migraine headaches with gonadotropin-releasing hormone agonist and „add-back“ therapy. Fertil Steril, 1997. 67(2): p. 390-3.
- Ferrante, F., et al., Phyto-oestrogens in the prophylaxis of menstrual migraine. Clin Neuropharmacol, 2004. 27(3): p. 137-40.
- Burke, B.E., R.D. Olson, and B.J. Cusack, Randomized, controlled trial of phytoestrogen in the prophylactic treatment of menstrual migraine. Biomed Pharmacother, 2002. 56(6): p. 283-8.
- Eikermann-Haerter, K., et al., Androgenic suppression of spreading depression in familial hemiplegic migraine type 1 mutant mice. Ann Neurol, 2009. 66(4): p. 564-8.
- Nappi, R.E., K. Wawra, and S. Schmitt, Hypoactive sexual desire disorder in postmenopausal women. Gynecol Endocrinol, 2006. 22(6): p. 318-23.
- MacGregor, E.A., Menstrual and perimenopausal migraine: A narrative review. Maturitas, 2020. 142: p. 24-30.
- Schoretsanitis, G., et al., Drug-drug interactions between psychotropic medications and oral contraceptives. Expert Opin Drug Metab Toxicol, 2022. 18(6): p. 395-411.
- Lazorwitz, A., et al., Effect of Topiramate on Serum Etonogestrel Concentrations Among Contraceptive Implant Users. Obstet Gynecol, 2022. 139(4): p. 579-587.
- Ornello, R., et al., Menstrual Headache in Women with Chronic Migraine Treated with Erenumab: An Observational Case Series. Brain Sci, 2021. 11(3).
- Pavlovic, J.M., et al., Efficacy and safety of erenumab in women with a history of menstrual migraine. J Headache Pain, 2020. 21(1): p. 95.
- Adewuyi, E.O., et al., Shared Molecular Genetic Mechanisms Underlie Endometriosis and Migraine Comorbidity. Genes (Basel), 2020. 11(3).
- Saddik, S.E., et al., Risk of Stroke in Migrainous Women, a Hidden Association: A Systematic Review. Cureus, 2022. 14(7): p. e27103.
- Siao, W.Z., et al., Risk of peripheral artery disease and stroke in migraineurs with or without aura: a nationwide population-based cohort study. Int J Med Sci, 2022. 19(7): p. 1163-1172.
- Champaloux, S.W., et al., Use of combined hormonal contraceptives among women with migraines and risk of ischemic stroke. Am J Obstet Gynecol, 2017. 216(5): p. 489.e1-489.e7.
- Hormonal Contraception. Guideline of the DGGG, SGGG and OEGGG (S3-Level, AWMF Registry No. 015/015, November 2019). https://register.awmf.org/de/leitlinien/detail/015-015.
- Diener, H.-C., et al., Therapie der Migräneattacke und Prophylaxe der Migräne, S1-Leitlinie, 2022, DGN und DMKG, in Leitlinien für Diagnostik und Therapie in der Neurologie, D.G.f.N. (Hrsg.), Editor. 2022: Online: www.dgn.org/leitlinien.
Pdf Download Publikation Schmerzmedizin 02 2023









Hinterlasse einen Kommentar