Liczne obszary mózgu istotne dla patofizjologii migreny, układ naczyniowy czaszki, opona twarda i róg tylny rdzenia kręgowego, wykazują ekspresję receptorów estrogenowych. Pozwala to na modulację bodźców bólowych. Napady migreny mogą występować w zależności czasowej od cyklu miesiączkowego. Migrena jest czynnikiem ryzyka udaru mózgu i innych incydentów naczyniowych. Istnieją liczne dowody na to, że zwiększone ryzyko udaru niedokrwiennego jest związane zarówno z migreną bez aury, jak i z aurą. Ponieważ ryzyko udaru może być również zwiększone w przypadku stosowania hormonalnych środków antykoncepcyjnych, istotne jest znalezienie praktycznych opcji leczenia.
Klasyfikacja migreny w odniesieniu do miesiączki
Obecna trzecia edycja Międzynarodowej Klasyfikacji Zaburzeń Bólu Głowy (ICHD3) [1], podobnie jak poprzednie edycje, nie zawiera w głównej części klasyfikacji sekcji dotyczącej ataków migreny występujących w odniesieniu do okna miesiączkowego. Pierwsze wydanie z 1988 r. [2] nie zawierało żadnych formalnych kryteriów migreny związanej z miesiączką. Jednak nawet w tym pierwszym wydaniu komentarz zauważył, że niektóre kobiety doświadczają ataków migreny bez aury wyłącznie podczas miesiączki. Określano to mianem „migreny menstruacyjnej”. Termin ten miał być stosowany tylko wtedy, gdy co najmniej 90% ataków wystąpiło w okresie od dwóch dni przed miesiączką do ostatniego dnia miesiączki. W drugiej edycji Międzynarodowej Klasyfikacji Zaburzeń Bólu Głowy z 2004 r. [3] po raz pierwszy zdefiniowano w dodatku dwa podtypy migreny związanej z miesiączką. Tak zwana „czysta migrena menstruacyjna” odnosi się do ataków występujących wyłącznie w związku z miesiączką. Natomiast tak zwana „migrena menstruacyjna” charakteryzuje się atakami występującymi w innych okresach cyklu miesiączkowego. Obie formy migreny stanowią podgrupy migreny bez aury. Dodatek do Międzynarodowej Klasyfikacji Bólów Głowy opisuje kryteria badawcze dla jednostek bólowych głowy, które nie zostały jeszcze wystarczająco potwierdzone badaniami naukowymi. Zarówno doświadczenie członków Komitetu Klasyfikacji Bólów Głowy, jak i publikacje o różnej jakości sugerują istnienie tych jednostek wymienionych w dodatku, które można uznać za odrębne jednostki chorobowe. Jednak, aby mogły one zostać formalnie zaakceptowane, potrzebne są dalsze dowody naukowe. Jeśli to się uda, diagnozy z dodatku będą mogły zostać włączone do głównej części klasyfikacji w kolejnej wersji.
Nawet w 3. edycji Międzynarodowej Klasyfikacji Zaburzeń Głowy (ICD) z 2018 roku „czysta migrena menstruacyjna” i „migrena związana z miesiączką” nadal występują jedynie w dodatku. W przypadku obu rozpoznań wymagane jest występowanie ataków migreny w 1. ± 2. dniu miesiączki (tj. od -2. do +3. dnia) w co najmniej 2 z 3 cykli miesiączkowych (Tabela 1, Ryc. 1). Jednakże kryteria zostały obecnie rozszerzone o podtyp z aurą, chociaż ataki migreny menstruacyjnej zwykle występują bez aury. Zatem zdefiniowano czystą migrenę menstruacyjną z aurą i bez niej, a także migrenę związaną z miesiączką z aurą i bez niej. Połączenie czystej migreny menstruacyjnej i migreny związanej z miesiączką oznacza, że termin „migrena menstruacyjna” jest używany jako termin ogólny [4].
Tabela 1. Kryteria diagnostyczne ICHD-3 dla migreny w okresie menstruacyjnym i poza nim
———————————————————————————
A1.1.1 Czysta migrena menstruacyjna bez aury
- Napady u kobiety miesiączkującej 1 , które spełniają migren bez aury
- Ataki występują wyłącznie w 1. ± 2. dniu (tj. od -2. do +3. dnia) pierwszej w co najmniej 2 z 3 cykli miesiączkowych i w żadnym innym momencie cyklu.
A1.1.2 Migrena związana z miesiączką bez aury
- Ataki u kobiet miesiączkujących, które spełniają kryteria migreny bez aury oraz kryterium B poniżej
- Ataki występują w 1. ± 2. dniu cyklu miesiączkowego ( czyli od -2. do +3. dnia) w co najmniej 2 z 3 cykli miesiączkowych, ale także w innych momentach cyklu.
A1.1.3 Migrena niemenstruacyjna bez aury
- Napady u kobiet miesiączkujących, które spełniają kryteria migren bez aury , a także kryterium B poniżej.
- niespełniające kryterium B dla A1.1.1, migreny czysto menstruacyjnej bez aury lub A1.1.2, migreny związanej z menstruacją bez aury
———————————————————————————
A1.2.0.1 Czysta migrena menstruacyjna z aurą
- Ataki u kobiety miesiączkującej 1 , które spełniają kryteria migren 1,2 z aurą i kryterium B poniżej
- Ataki występują w 1. ± 2. dniu cyklu miesiączkowego (tj. od -2. do +3. dnia) co najmniej w 2 z 3 cykli miesiączkowych, ale także w innych momentach cyklu.
A1.2.0.2 Migrena menstruacyjna z aurą
- Ataki u kobiet miesiączkujących, które spełniają kryteria migreny 1,2 z aurą i kryterium B poniżej
- Ataki występują w 1. ± 2. dniu cyklu miesiączkowego ( czyli od -2. do +3. dnia) w co najmniej 2 z 3 cykli miesiączkowych, ale także w innych momentach cyklu.
A1.2.0.3 Migrena niezwiązana z miesiączką z aurą
- Ataki u kobiet miesiączkujących, które spełniają kryteria migreny 1,2 z aurą i kryterium B poniżej
- niespełniające kryterium B dla A1.2.0.1, typowej migreny menstruacyjnej z aurą lub A1.2.0.2, migreny menstruacyjnej z aurą
———————————————————————————
W rozumieniu ICHD-3, miesiączkę uważa się za krwawienie z endometrium wynikające z prawidłowego endogennego cyklu miesiączkowego lub odstawienia progestagenów zewnętrznych, co ma miejsce w przypadku złożonych doustnych środków antykoncepcyjnych i cyklicznej hormonalnej terapii zastępczej (ryc. 1). Rozróżnienie między migreną typowo menstruacyjną bez aury a migreną związaną z menstruacją bez aury jest istotne według ICHD-3, ponieważ w tym drugim przypadku profilaktyka hormonalna jest bardziej skuteczna [1].
Ponad 50% kobiet z migreną zgłasza związek między miesiączką a migreną [5]. Częstość występowania różni się w zależności od badań ze względu na odmienne kryteria diagnostyczne. Częstość występowania migreny menstruacyjnej bez aury waha się od 7% do 14% u pacjentek z migreną, podczas gdy częstość występowania migreny menstruacyjnej bez aury waha się od 10% do 71% u pacjentek z migreną. Około jedna na trzy do pięciu pacjentek z migreną doświadcza ataku migreny bez aury w związku z miesiączką [5]. Wiele kobiet ma tendencję do przeceniania związku między miesiączką a atakami migreny; w celach badawczych rozpoznanie wymaga prospektywnie udokumentowanych dowodów co najmniej trzech cykli, popartych aplikacją do monitorowania migreny lub wpisami w dzienniku [1].
Mechanizmy migreny mogą się różnić w zależności od tego, czy krwawienie z endometrium występuje w następstwie prawidłowego endogennego cyklu miesiączkowego, czy też w wyniku odstawienia progestagenów zewnętrznych (jak w przypadku złożonych doustnych środków antykoncepcyjnych i cyklicznej hormonalnej terapii zastępczej). Endogenny cykl miesiączkowy wynika ze złożonych zmian hormonalnych w osi podwzgórze-przysadka-jajniki, które wyzwalają owulację, hamowaną przez stosowanie złożonych doustnych środków antykoncepcyjnych. Dlatego te subpopulacje należy rozpatrywać patofizjologicznie oddzielnie, nawet jeśli kryteria diagnostyczne nie są wzajemnie rozróżnialne.
Istnieją dowody na to, że przynajmniej u niektórych kobiet napady migreny menstruacyjnej mogą być wywoływane odstawieniem estrogenów, chociaż inne zmiany hormonalne lub biochemiczne w tym momencie cyklu mogą mieć również znaczenie [4]. Jeśli migrena czysto menstruacyjna lub migrena związana z menstruacją jest związana z odstawieniem estrogenów egzogennych, należy postawić obie diagnozy: migrena czysto menstruacyjna bez aury lub migrena związana z menstruacją bez aury i ból głowy związany z odstawieniem estrogenów. Związek z menstruacją może zmieniać się w trakcie życia reprodukcyjnego kobiety.
Wpływ hormonów na bóle głowy
Wpływ hormonów na bóle głowy został uwzględniony w sekcji głównej „bóle głowy wtórne” w drugim wydaniu Międzynarodowej Klasyfikacji Bólów Głowy z 2004 r. (ICHD-2) [3]. Kryteria dotyczą bólów głowy, które pojawiły się niedawno w związku z przyjmowaniem hormonów lub bólów głowy, które nasilają się w przeszłości. Kryteria wymagają, aby bóle głowy ustąpiły po odstawieniu hormonów lub, w przypadku bólów głowy, które występowały wcześniej, aby powrócił poprzedni wzorzec.
Trzecia edycja ICHD-3 (2018) [1] wymagała występowania bólów głowy przez co najmniej 15 dni w miesiącu, aby rozpoznać ból głowy związany z hormonami egzogennymi. Rozpoznanie bólu głowy związanego z odstawieniem estrogenów według ICHD-3 wymaga, aby bóle głowy rozpoczęły się w ciągu 5 dni od zaprzestania przyjmowania estrogenów, jeśli kobieta przyjmowała je przez co najmniej trzy tygodnie.
Estrogeny i migreny
W 1972 roku Somerville opisał, w jaki sposób domięśniowe wstrzyknięcie walerianianu estradiolu, estru proleku 17β-estradiolu, krótko przed miesiączką może opóźnić wystąpienie ataku migreny związanego z miesiączką [6]. Zidentyfikowano progowe stężenie krążącego 17β-estradiolu wynoszące 45–50 pg/ml, poniżej którego może zostać wywołany atak migreny. Próg ten obserwowano również u kobiet po menopauzie poddawanych hormonalnej terapii zastępczej domięśniowym podawaniem 17β-estradiolu. Na podstawie tych danych postawiono hipotezę, że ataki migreny w okresie menstruacyjnym są wyzwalane przez spadek poziomu estrogenu. Założono ponadto, że fizjologiczne wahania poziomu estrogenu odgrywają rolę w patogenezie migreny. Założenie to zostało poparte odkryciem, że istnieje szczególna podatność na ataki migreny podczas spadku poziomu estrogenu w późnej fazie lutealnej. Jednakże nie wykazano różnic w maksymalnych lub średnich dziennych stężeniach estrogenu podczas cykli owulacyjnych u pacjentek cierpiących na migrenę w porównaniu ze zdrowymi osobami kontrolnymi [4, 7].
Estrogen i układ nerwowy
Najistotniejszym endogennym estrogenem jest 17β-estradiol [8]. Wnika on do ośrodkowego układu nerwowego poprzez bierną dyfuzję przez barierę krew-mózg. Może być jednak również syntetyzowany lokalnie w mózgu z cholesterolu lub z aromatyzowanych prekursorów przez enzym aromatazę i działać tam jako neurosteroid. Efekty fizjologiczne mogą być pośredniczone przez aktywację różnych receptorów estrogenowych, w szczególności receptora estrogenowego α (ERα), receptora estrogenowego β (ERβ) i receptora estrogenowego sprzężonego z białkiem G-1 (GPER/GPR30) [9].
Estrogeny wywierają swoje działanie biologiczne w ośrodkowym układzie nerwowym poprzez mechanizmy komórkowe genomiczne lub niegenomowe. Może to wpływać na neurotransmisję i funkcjonowanie komórek. Kaskady sygnalizacji wewnątrzkomórkowej mogą modyfikować reakcje enzymatyczne, przewodnictwo kanałów jonowych i pobudliwość neuronów [4].
Liczne obszary mózgu zaangażowane w patofizjologię migreny wykazują ekspresję receptorów estrogenowych. Dotyczy to w szczególności podwzgórza, móżdżku, układu limbicznego, jąder mostu i istoty szarej okołowodociągowej (substantia grisea periaquaeductalis). Receptory estrogenowe występują również w korze mózgowej, modulując w ten sposób wrażliwość na ból zarówno drogą aferentną, jak i eferentną. Układ naczyniowy czaszki, opona twarda i róg tylny rdzenia kręgowego również wykazują ekspresję receptorów estrogenowych, modulując w ten sposób bodźce bólowe [4, 8, 9].
Badania asocjacyjne obejmujące cały genom nie wykazały korelacji między polimorfizmami receptora estrogenowego a zwiększonym ryzykiem migreny. Zidentyfikowano jednak pojedynczy polimorfizm nukleoidowy w genie SYNE1 powiązany z migreną menstruacyjną [10].
Układ serotoninergiczny może być aktywowany przez estrogen, co może mieć działanie ochronne przed atakami migreny [11]. Estrogen może również nasilać pobudzające działanie glutaminianu. Może to wyjaśniać zwiększone prawdopodobieństwo wystąpienia aury migrenowej w okresach wysokiego stężenia estrogenów, na przykład w czasie ciąży lub podczas przyjmowania hormonów egzogennych.
Estrogen może modulować układ kwasu γ-aminomasłowego (GABA), który ma działanie hamujące na układ nerwowy [12]. Progesteron, który jest produkowany głównie przez ciałko żółte jajników, a także jego metabolit allopregnanolon, mogą nasilać aktywność GABA-ergiczną i w ten sposób wywierać działanie przeciwbólowe.
Estrogeny mogą również modulować endogenny układ opioidowy poprzez zwiększenie syntezy enkefaliny [13]. W związku z tym obniżone poziomy estrogenu i progesteronu w późnej fazie lutealnej mogą korelować ze zmniejszoną aktywacją układu opioidowego. Prowadzi to do zwiększonej wrażliwości na ból. Badania nad wrażliwością na ból w różnych fazach cyklu menstruacyjnego wykazały zwiększoną wrażliwość w fazie lutealnej, szczególnie u kobiet doświadczających objawów przedmiesiączkowych [14]. Wysokie stężenia estrogenów promują również produkcję innych hamujących ból neuroprzekaźników i neuropeptydów, takich jak neuropeptyd Y, prolaktyna i wazopresyna, które mogą odgrywać rolę w rozwoju migreny [4].
Oksytocyna i migrena
Neuropeptyd oksytocyna jest produkowany w podwzgórzu. Ma szeroki wpływ na ośrodkowy układ nerwowy. W szczególności moduluje nastrój i zachowanie. Wpływa na kontrolę bólu przez organizm i może mieć działanie zapobiegające migrenie [4]. W okresach podwyższonego stężenia estrogenu wzrasta również poziom oksytocyny. Estrogen prowadzi do zwiększonej produkcji oksytocyny w podwzgórzu i innych obszarach mózgu, zwłaszcza w jądrze ogonowym nerwu trójdzielnego [15]. Kobiety cierpiące na migrenę menstruacyjną wykazują obniżony próg bólu w fazie bezhormonalnej podczas stosowania złożonych hormonalnych środków antykoncepcyjnych, tj. w czasie obniżonego stężenia estrogenu [16].
Patofizjologia migreny wiąże się ze zwiększoną aktywnością nocyceptywną kory mózgowej w układzie trójdzielno-naczyniowym. Prowadzi to zarówno do rozszerzenia naczyń wewnątrzczaszkowych, jak i zapalenia opon mózgowo-rdzeniowych [15]. Lokalna aktywacja receptorów estrogenowych w zwoju trójdzielnym może wywołać ataki migreny. Kobiety mają więcej receptorów estrogenowych w zwoju trójdzielnym niż mężczyźni [17]. Estrogeny mogą silnie wpływać na napięcie naczyń poprzez hamowanie kanałów wapniowych w mięśniach gładkich [18]. Estrogeny mogą również aktywować rozprzestrzeniającą się depresję korową (CSD), korową depolaryzację neuronalną, która jest uważana za charakterystyczną cechę migreny z aurą [19]. Wysokie poziomy estrogenów zwiększają podatność na CSD, podczas gdy niedobór estrogenów ją zmniejsza. Może to wyjaśniać, dlaczego ataki migreny w czasie okna menstruacyjnego rzadziej wiążą się z aurą [1].
Estrogeny i peptydy związane z genem kalcytoniny (CGRP)
Uwalnianie peptydu związanego z genem kalcytoniny (CGRP) jest obecnie uważane za kluczowy etap w patofizjologii migreny. Stymulacja zwoju trójdzielnego może prowadzić do uwolnienia CGRP i substancji P do krwiobiegu czaszkowego [20]. CGRP aktywuje mechanizmy nocyceptywne w oponie twardej, zwoju trójdzielnym, kompleksie jądra nerwu trójdzielnego szyjnego, wzgórzu i istocie szarej okołowodnokanalizacyjnej, między innymi [20]. Zarówno objawy kliniczne migreny, jak i uwalnianie CGRP mogą być blokowane przez tryptany [21]. Wlewy CGRP mogą wywołać atak u pacjentów z migreną [22]. Nie ma to jednak miejsca w przypadku zdrowych osób kontrolnych. Obecnie dostępne są przeciwciała monoklonalne, które specyficznie celują w CGRP jako ligand (eptinezumab, fremanezumab i galcanezumab) lub receptor CGRP (erenumab) w leczeniu zapobiegawczym migreny epizodycznej i przewlekłej [23, 24]. Wykazano ich skuteczność i dobrą tolerancję w kontrolowanych badaniach klinicznych.
Poziomy CGRP są wyższe u kobiet niż u mężczyzn [25]. Są one również podwyższone w czasie ciąży i podczas stosowania złożonych hormonalnych środków antykoncepcyjnych. W okresie menopauzy poziomy są zmienne [26]. Receptory CGRP i estrogenu są wyrażone w tych samych obszarach mózgu. Estrogen może modulować produkcję CGRP w neuronach nerwu trójdzielnego. Eksperymentalnie, podawanie egzogennego estrogenu prowadzi do obniżenia poziomu CGRP [27]. W okresie postmenopauzy poziomy CGRP mogą być podwyższone, a stężenia estrogenu obniżone [28].
Substancja P, neuropeptyd wazoaktywny, może również powodować neurogenne zapalenie opon mózgowo-rdzeniowych związane z migreną [28]. Podawanie estrogenu może zmniejszyć stężenie substancji P w osoczu. Podsumowując, estrogen może modulować zarówno CGRP, jak i substancję P poprzez działanie hamujące. Estrogen zapewnia zatem mechanizm ochronny przed zapaleniem neurogennym [28]. Ponadto estrogen może hamować aktywujące działanie progesteronu na CGRP i substancję P. Sugeruje to, że połączenie estrogenu i progesteronu ma stabilizujący wpływ na uwalnianie CGRP i substancji P [4].
U pacjentów z migreną obserwuje się podwyższony poziom cytokinin prozapalnych zarówno w trakcie, jak i pomiędzy atakami migreny [29]. Badania eksperymentalne sugerują, że estrogeny mogą hamować krążące cząsteczki zapalne. Ponadto działają ochronnie na stan zapalny wywołany prostaglandynami. Z kolei niedobór estrogenów może zwiększać wrażliwość na prostaglandyny i aktywować neurozapalenie poprzez zwiększenie uwalniania neuropeptydów, takich jak CGRP, substancja P i neurokinina [30].
Podsumowując, dostępne dane wskazują, że estrogen nie wywiera bezpośredniego działania ochronnego na napady migreny. Może on jednak pośrednio wpływać na czynniki aktywujące i hamujące migrenę. W konsekwencji inicjacja napadów migreny w układzie nerwowo-naczyniowym może zostać zahamowana. W krążeniu trójdzielnym wrażliwość na migrenę może być zmniejszona. Obniżenie stężenia estrogenu może obniżyć próg wystąpienia napadów migreny [4, 15].
Estrogeny w profilaktyce migren menstruacyjnych
U niektórych pacjentów napady migreny mogą występować wyłącznie w okresie menstruacyjnym [1]. Napady te mogą charakteryzować się znacznie silniejszym bólem (czas trwania, intensywność, nasilenie pod wpływem aktywności fizycznej) i towarzyszącymi objawami (nudności, wymioty, światłowstręt i fonofobia) w porównaniu z napadami migreny występującymi poza okresem menstruacyjnym.
Manipulowanie naturalnym stężeniem estrogenu może być sposobem zapobiegania napadom migreny związanym z miesiączką. Celem jest ograniczenie wahań hormonalnych i spadku poziomu estrogenu podczas miesiączki. Wynika to z obserwacji, że podatność na napady migreny w okresie okołomiesiączkowym (dni -2 i +3 miesiączki) koreluje ze spadkiem poziomu hormonów [31].
Zasadniczo istnieją dwa podejścia do stosowania hormonów w leczeniu zapobiegawczym migreny menstruacyjnej:
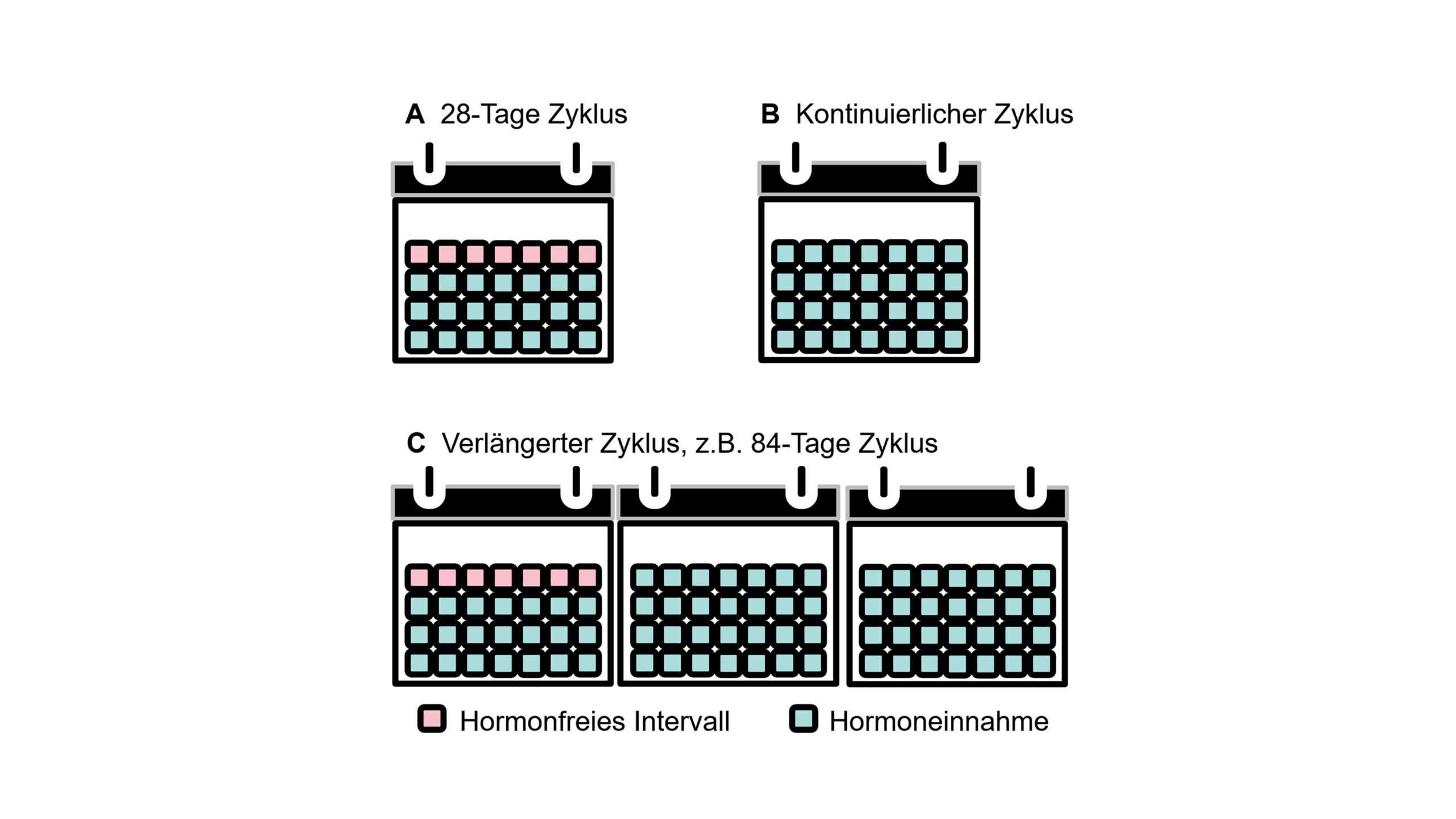
- Hormonalne środki antykoncepcyjne można stosować w różnych schematach podawania etynyloestradiolu, w zależności od długości przerwy w przyjmowaniu hormonów. Schematy te obejmują standardowy schemat 21/7, schematy o zmiennej długości oraz schematy ciągłe bez przerw w przyjmowaniu hormonów (ryc. 2). Dostępne opcje podawania obejmują doustne hormonalne środki antykoncepcyjne i krążki dopochwowe.
- Ponadto można stosować suplementy estrogenowe nieprzeznaczone do antykoncepcji. Przykładami są plastry transdermalne, żele i implanty podskórne. Mają one na celu kompensację spadku poziomu estrogenów w okresie okołomiesiączkowym w przypadku migreny menstruacyjnej i czystej migreny menstruacyjnej.
Dane dotyczące stosowania hormonów w profilaktyce migreny menstruacyjnej są bardzo ograniczone i częściowo sprzeczne. Uzasadnieniem jest kompensacja spadku endogennego estrogenu u pacjentek z czystą migreną menstruacyjną, u których miesiączka jest przewidywalna [4, 32, 33]. Z drugiej strony, ciągłe podawanie małych dawek ma na celu przeciwdziałanie fizjologicznym wahaniom hormonalnym. Skojarzone podawanie estrogenu i progestagenów ma na celu stabilizację poziomu hormonów i umożliwienie antykoncepcji [4, 32, 33]. Poniżej opisano różne możliwości wpływania na cykl hormonalny kobiety w leczeniu migreny.
Dezogestrel (lek zawierający wyłącznie progestagen)
Cztery otwarte badania obserwacyjne badały wpływ dezogestrelu w dawce 75 µg na dobę u kobiet z migreną z aurą i bez aury [34-37]. Badane kobiety przyjmowały lek w celach antykoncepcyjnych lub z przyczyn medycznych – ale nie w ukierunkowanej profilaktyce migreny. Działania niepożądane dezogestrelu obejmowały nasilenie bólów głowy, wydłużenie czasu krwawienia, plamienie i trądzik. Z kolei istnieją jedynie ograniczone dowody na skuteczność dezogestrelu w leczeniu migreny u kobiet z migreną bez aury lub z aurą. Biorąc pod uwagę korzystny profil ryzyka sercowo-naczyniowego, dezogestrel można rozważyć u kobiet z migreną z aurą lub bez aury oraz dodatkowymi czynnikami ryzyka naczyniowego.
Środki antykoncepcyjne złożone
Aktualne badania nad przedłużonym stosowaniem złożonych doustnych środków antykoncepcyjnych u kobiet z migreną są ograniczone [4, 32]. Również w tym przypadku dostępne są jedynie otwarte badania obserwacyjne, przeprowadzone u kobiet przyjmujących lek w celu antykoncepcji lub z przyczyn medycznych – a nie w profilaktyce migreny. Tylko jedno badanie dotyczyło konkretnie złożonych doustnych środków antykoncepcyjnych w profilaktyce bólów głowy [38]. Dostępne dane sugerują potencjalne korzyści z długotrwałego stosowania złożonych hormonalnych środków antykoncepcyjnych u kobiet z migreną bez aury.
Dezogestrel a długotrwałe stosowanie złożonych doustnych środków antykoncepcyjnych
Otwarte badania obserwacyjne porównywały skuteczność minipigułki dezogestrelu z przedłużonym stosowaniem złożonych doustnych środków antykoncepcyjnych w migrenie bez aury. Badanie Morotti i wsp. [36] nie wykazało różnic w liczbie dni z migreną, dniach z bólem głowy, intensywności bólu głowy ani dniach stosowania tryptanów. Aktualne badania porównujące minipigułki dezogestrelu z doustnymi środkami antykoncepcyjnymi są ograniczone. Wyniki badań obserwacyjnych nie pozwalają na wyciągnięcie ostatecznych wniosków dotyczących skuteczności.
Złożone doustne środki antykoncepcyjne ze skróconą przerwą w przyjmowaniu tabletek
W przypadku stosowania złożonych doustnych środków antykoncepcyjnych ze skróconą przerwą w przyjmowaniu tabletek dostępne są jedynie badania niskiej jakości [4, 32]. Badania te wykazują bardzo zróżnicowane schematy leczenia. Nie ma dowodów na wyższość któregokolwiek ze schematów w porównaniu z innymi opcjami. Brakuje wystarczających dowodów uzasadniających stosowanie tej terapii wyłącznie w profilaktyce migreny. U niektórych kobiet leczenie musiało zostać przedwcześnie przerwane z powodu nasilenia migreny.
Złożone doustne środki antykoncepcyjne z doustnym podawaniem estrogenu w okresie „bez tabletek”
Dowody na skuteczność doustnych złożonych środków antykoncepcyjnych z doustną terapią zastępczą estrogenem w okresie przerwy w przyjmowaniu tabletek pochodzą jedynie z jednego badania [39]. Aktualne dane nie pozwalają na wyciągnięcie wniosków dotyczących skuteczności tego schematu leczenia w przebiegu migreny.
Połączone doustne środki antykoncepcyjne z suplementacją estradiolu w postaci plastra w okresie przerwy w przyjmowaniu tabletek
W badaniu jednoośrodkowym nie zaobserwowano istotnej redukcji liczby dni z migreną, jej nasilenia ani objawów [40]. Do działań niepożądanych związanych z przezskórną suplementacją estradiolu należały zaburzenia krwawienia z odstawienia. Aktualne dane nie dostarczają wystarczającego uzasadnienia dla stosowania plastrów z estradiolem w profilaktyce migreny w okresie przerwy w przyjmowaniu tabletek.
Plastry antykoncepcyjne hormonalne łączone
Dane dotyczące stosowania złożonych hormonalnych plastrów antykoncepcyjnych są bardzo ograniczone. Dane pochodzą jedynie z jednego badania [41]. Wyniki tego badania sugerują związek między odstawieniem hormonów a występowaniem bólów głowy. Liczba dni z bólem głowy była wyższa w tygodniu bez plastra. Po usunięciu plastra po długotrwałym leczeniu, częstość występowania bólów głowy nie wzrosła. Aktualny zbiór badań nie dostarcza dowodów na skuteczność tego podejścia.
Pierścień dopochwowy hormonalny do antykoncepcji
Stosowanie złożonej antykoncepcji hormonalnej z pierścieniem dopochwowym w przebiegu migreny jest również bardzo ograniczone [42]. Dostępne dane są niewystarczające, aby uzasadnić jej stosowanie w profilaktyce migreny [4, 32].
Transdermalna suplementacja estradiolu za pomocą żelu
Wpływ suplementacji żelem transdermalnym estradiolem u pacjentek przed menopauzą badano w trzech badaniach [43-45]. Żel estradiolowy w dawce 1,5 mg podawano przez 6 lub 7 dni. Efekt porównywano z placebo. Leczenie w tych badaniach miało na celu zapobieganie bólom głowy. Nie zgłoszono żadnych poważnych zdarzeń niepożądanych związanych ze stosowaniem żelu estradiolowego. Wysypka, lęk lub brak miesiączki zostały udokumentowane jako działania niepożądane. W oparciu o obecne dowody, stosowanie żelu transdermalnego estradiolowego w zapobieganiu migrenie nie jest wystarczająco uzasadnione. Z jednej strony podawanie żelu transdermalnego estradiolowego jest proste i ogólnie dobrze tolerowane. Z drugiej strony, czas aplikacji może być problematyczny w przypadku nieregularnych miesiączek. Potencjalne nasilenie objawów migreny z powodu opóźnionego odstawienia estrogenu może być również wadą. Może to być spowodowane zwiększonym podawaniem estradiolu z dodatkową suplementacją estradiolu i wyraźniejszym spadkiem. Wzrost endogennego estrogenu w pęcherzykach można również zahamować poprzez podanie egzogenne. Ze względu na brak danych, stosowanie żelu estrogenowego nie może być obecnie zalecane w profilaktyce migreny menstruacyjnej. Takie podejście można rozważyć jedynie wtedy, gdy wszystkie inne strategie okażą się niewystarczająco skuteczne w zapobieganiu migrenie menstruacyjnej.
Transdermalna suplementacja estradiolu za pomocą plastra
Dowody na skuteczność suplementacji estradiolem w postaci plastrów transdermalnych w leczeniu migreny menstruacyjnej są ograniczone. Uzasadnieniem dla ich stosowania jest utrzymanie stabilnego stężenia estradiolu przed wystąpieniem miesiączki [41]. Obecnie brak danych potwierdzających skuteczność suplementacji estradiolem w postaci plastrów w przebiegu migreny.
Transdermalna suplementacja estrogenem za pomocą plastrów u kobiet z menopauzą wywołaną farmakologicznie
Stosowanie transdermalnych plastrów z estradiolem u kobiet z menopauzą wywołaną farmakologicznie nie jest wystarczająco uzasadnione na podstawie aktualnych danych. W okresie menopauzy wywołanej farmakologicznie wzrasta ryzyko osteoporozy, depresji, uderzeń gorąca, drażliwości, spadku libido i suchości pochwy. Ryzyko to można zmniejszyć poprzez suplementację estrogenem [46]. Aktualne dowody są niewystarczające, aby uzasadnić jego stosowanie w profilaktyce migreny.
Podskórny implant estrogenowy z cyklicznym progestagenem
W otwartym badaniu obserwacyjnym zbadano zastosowanie podskórnego implantu estrogenowego z cyklicznym progestagenem [47]. Dostępne dane nie pozwalają na wyciągnięcie wystarczających wniosków dotyczących jego potencjalnego zastosowania w profilaktyce migreny.
Terapia add-back
Przebieg bólów głowy badano u kobiet otrzymujących analog hormonu uwalniającego gonadotropinę (GnRH), czynnik wywołujący przejściową jatrogenną menopauzę, oraz przezskórny plaster z estrogenem, w monoterapii lub w skojarzeniu z progestagenem (terapia uzupełniająca) [48]. Zaobserwowano zmniejszenie nasilenia bólów głowy, ale nie częstości ich występowania. Badanie to sugeruje, że zmniejszenie wahań hormonalnych może być korzystne w zapobieganiu migrenie pozamiesiączkowej.
Fitoestrogeny
Fitoestrogeny to wtórne związki roślinne, takie jak izoflawony i lignany. Nie są estrogenami w sensie chemicznym, ale mają podobieństwa strukturalne. Powoduje to słabe działanie estrogenne lub antyestrogenne. Najbardziej znanymi fitoestrogenami są izoflawony genisteina, daidzeina i kumestrol. Genisteina i daidzeina są w szczególności stosowane w celu łagodzenia uderzeń gorąca i innych objawów menopauzy, a także migreny menstruacyjnej. W badaniu otwartym trwającym 10 dni w trakcie cyklu menstruacyjnego (od -7 do +3 dni) zaobserwowano średnią redukcję dni z bólem głowy o 62% [49]. Połowa pacjentek zgłosiła brak nudności i wymiotów związanych z migreną. Randomizowane badanie kontrolowane potwierdziło ten efekt w ciągu 24 tygodni z zastosowaniem schematu leczenia 60 mg izoflawonów sojowych, 100 mg dzięgla chińskiego i 50 mg pluskwicy groniastej [50]. Badanie wykazało bardzo istotną redukcję migreny menstruacyjnej, stosowania leków doraźnych oraz nasilenia bólu głowy. Fitoestrogeny mogą zatem stanowić potencjalną opcję dla kobiet, które nie chcą stosować terapii hormonalnej lub nie mogą jej stosować z powodu przeciwwskazań, takich jak wysokie ryzyko sercowo-naczyniowe.
Dalsze leczenie hormonalne
Badania nad stosowaniem antykoncepcji w profilaktyce bólów głowy wykazały, że indukowanie braku miesiączki wiąże się ze znaczną redukcją bólów głowy [4, 32]. Terapie oparte wyłącznie na progesteronie wiążą się z mniejszym ryzykiem zdarzeń sercowo-naczyniowych lub powikłań niż estrogeny [4, 30, 33]. Mogą być one również skuteczne w zapobieganiu migrenie z aurą. Dzięki ciągłemu podawaniu nie występują wahania poziomu żeńskich hormonów płciowych związane z cyklem ani ostre odstawienie estrogenów.
Badania przedkliniczne wykazały, że testosteron hamuje rozprzestrzenianie się depresji korowej [51]. Podskórne podanie implantów testosteronu może zmniejszyć nasilenie bólów głowy u pacjentów z niedoborem androgenów. Po ooforektomii z niedoborem androgenów kobiety zgłaszają zwiększoną częstość występowania migren w porównaniu z kobietami wkraczającymi w naturalną menopauzę [52].
Kobiety poddane hormonalnej terapii zastępczej (HRT) w okresie menopauzy często doświadczają nasilenia bólów głowy [53]. Jest to prawdopodobnie spowodowane nieregularnym uwalnianiem estrogenu. HRT może pomóc w stabilizacji objawów odstawienia estrogenu w takiej sytuacji. Należy stosować najniższą skuteczną dawkę, aby kontrolować objawy menopauzy i uniknąć działań niepożądanych ze strony układu sercowo-naczyniowego, szczególnie w przypadku migreny z aurą. Przezskórne podawanie estrogenu lub stosowanie ciągłych schematów leczenia skojarzonego, takich jak HRT, które zapobiegają krwawieniu, może być najlepszym podejściem do zapobiegania migrenie w tej sytuacji.
Topiramat, migrena menstruacyjna i antykoncepcja
Topiramat jest zatwierdzony do leczenia zapobiegawczego migreny i jest również stosowany w leczeniu migreny menstruacyjnej. W przypadku stosowania topiramatu w dawkach dobowych powyżej 200 mg, należy wziąć pod uwagę możliwość zmniejszenia skuteczności antykoncepcji i nasilenia krwawienia międzymiesiączkowego u pacjentek stosujących złożone doustne środki antykoncepcyjne [54]. Kobietom stosującym antykoncepcję zawierającą estrogen należy zalecić informowanie lekarza o wszelkich zmianach w krwawieniu miesiączkowym. Skuteczność antykoncepcji może być zmniejszona podczas leczenia topiramatem nawet w przypadku braku krwawienia międzymiesiączkowego [55].
CGRP-mAK i migrena menstruacyjna
Obecnie nie ma specyficznego leczenia zapobiegawczego migreny menstruacyjnej. Ostatnio badano zastosowanie przeciwciał monoklonalnych przeciwko CGRP lub receptorowi CGRP w leczeniu migreny menstruacyjnej. Ze względu na długi okres półtrwania mają one tę zaletę, że szczególnie w leczeniu długotrwałym należy je podawać tylko co miesiąc lub co trzy miesiące. Galcanezumab, erenumab, eptinezumab i fremanezumab są obecnie dostępne w Niemczech w leczeniu zapobiegawczym migreny. W badaniu z erenumabem [56] porównano przebieg migreny menstruacyjnej między grupą, która odpowiedziała na erenumab, a grupą, która nie odpowiedziała. Wyniki wykazały, że w obu grupach częstość występowania bólów głowy była wyższa w oknie menstruacyjnym niż poza nim. Oznacza to, że nawet w przypadku leczenia erenumabem, migrena występuje częściej w oknie menstruacyjnym niż poza nim. W innym badaniu analizowano skuteczność erenumabu w zapobieganiu migrenie menstruacyjnej [57]. Miesięczna liczba dni z migreną obejmowała zarówno ataki migreny okołomiesiączkowej, jak i międzymiesiączkowej. Erenumab w dawkach 70 mg i 140 mg istotnie zmniejszył częstość dni z migreną w miesiącu w porównaniu z placebo. Dane te potwierdzają skuteczność erenumabu w zapobieganiu migrenie menstruacyjnej [57].
Ryzyko sercowo-naczyniowe
Pacjenci z migreną mają około dwukrotnie większe ryzyko udaru mózgu w porównaniu ze zdrowymi osobami kontrolnymi. Dotyczy to szczególnie migreny z aurą. Migrena jest czynnikiem ryzyka udaru mózgu tak samo istotnym jak trombofilia, przetrwały otwór owalny, rozwarstwienie tętnicy, palenie tytoniu i otyłość [4, 30, 32, 33, 58-60].
Estrogeny poprawiają zależny od śródbłonka przepływ krwi i profil lipidowy. Mają jednak również działanie prozakrzepowe i prozapalne. Może to być szczególnie istotne u pacjentów ze zwiększonym ryzykiem udaru mózgu i innych zdarzeń naczyniowych, takich jak zawał mięśnia sercowego lub zakrzepica żył głębokich. Stosowanie złożonych doustnych środków antykoncepcyjnych może wiązać się z wcześniejszym wystąpieniem udaru mózgu [4, 32, 61, 62].
Zasadniczo obecność dwóch niezależnych czynników ryzyka udaru mózgu musi być starannie rozważona. Badania pokazują, że kobiety z migreną, które również stosują złożone hormonalne środki antykoncepcyjne, mają zwiększone ryzyko udaru mózgu o 2,1–13,9 [33, 61]. Ryzyko udaru mózgu koreluje z dawką estrogenu. Wytyczne ekspertów Europejskiej Federacji Bólów Głowy (EHF) i Europejskiego Towarzystwa Antykoncepcji i Zdrowia Reprodukcyjnego (ESCRH) [32, 33], Niemieckiego Towarzystwa Neurologicznego (DGN) we współpracy z Niemieckim Towarzystwem Migreny i Bólów Głowy [63] oraz Niemieckiego Towarzystwa Ginekologii i Położnictwa [62] nie zalecają stosowania złożonych hormonalnych środków antykoncepcyjnych u pacjentek z migreną z aurą. Pacjentki z migreną bez aury nie powinny stosować złożonych hormonalnych środków antykoncepcyjnych, jeśli występują inne naczyniowe czynniki ryzyka. Alternatywnie można rozważyć stosowanie środków antykoncepcyjnych zawierających wyłącznie progestagen lub doustnych środków antykoncepcyjnych zawierających dawki estrogenu mniejsze niż 35 µg.
Aby zapobiegać migrenie menstruacyjnej, można stosować schematy leczenia o wydłużonym cyklu oraz leczenie o stabilnym poziomie hormonów, takie jak podawanie przezpochwowe lub przezskórna suplementacja estradiolu. U tych pacjentek można również rozważyć niskie dawki estrogenu. Jednak obecne dane są wciąż niewystarczające, aby móc wiarygodnie oceniać skuteczność i tolerancję. Chociaż monoterapia progestagenem charakteryzuje się najbezpieczniejszym profilem ryzyka naczyniowego, nadal mogą wystąpić działania niepożądane, takie jak krwawienie międzymiesiączkowe.
Ogólnie rzecz biorąc, badania pokazują, że terapia estrogenowa jest najskuteczniejszą i najlepiej tolerowaną metodą leczenia. Istotne będą również przyszłe badania nad skutecznością i tolerancją naturalnego estrogenu. Krótki okres bezhormonalny jest prawdopodobnie najskuteczniejszym sposobem zapobiegania spadkowi poziomu estrogenu, który mógłby potencjalnie wywołać atak migreny. Jednak, aby wyciągnąć wiarygodne wnioski w tym zakresie, potrzebne są dalsze kontrolowane badania.
Aktualne zalecenia dotyczące profilaktyki migreny menstruacyjnej
Aktualne wytyczne Niemieckiego Towarzystwa Neurologicznego (DGN) we współpracy z Niemieckim Towarzystwem Migreny i Bólów Głowy [63] z 2022 r. zalecają stosowanie długo działającego NLPZ naproksenu (okres półtrwania 12–15 godzin) lub tryptanu o długim okresie półtrwania w krótkotrwałej profilaktyce migreny menstruacyjnej. Leki należy podawać przez 5–6 dni, rozpoczynając 2 dni przed spodziewanym wystąpieniem miesiączki. Ponadto, ciągłe przyjmowanie złożonych doustnych środków antykoncepcyjnych można rozważyć jako środek zapobiegawczy. Podawanie dezogestrelu można również rozważyć w profilaktyce migreny menstruacyjnej.
Istnieją badania kontrolowane placebo dotyczące stosowania frowatryptanu 2,5 mg raz, dwa razy lub trzy razy dziennie, zolmitryptanu 2,5 mg dwa razy lub trzy razy dziennie, naratryptanu 1 mg lub 2,5 mg dwa razy dziennie oraz naproksenu 550 mg dwa razy dziennie. Podawanie leków należy rozpocząć dwa dni przed spodziewanym wystąpieniem ataku migreny w trakcie cyklu menstruacyjnego i kontynuować przez łącznie 6–7 dni. Ryzyko wystąpienia bólu głowy z powodu nadużywania leków podczas stosowania naproksenu lub tryptanu w krótkotrwałej profilaktyce migreny menstruacyjnej jest uważane za niskie, pod warunkiem stosowania niewielu innych leków doraźnych.
Aktualne wytyczne nie zalecają przezskórnego podawania estrogenu. Wynika to z opóźnionego wystąpienia ataków migreny po odstawieniu żelu estrogenowego. Przezskórną suplementację estrogenem należy rozważyć tylko wtedy, gdy inne środki zapobiegawcze są nieskuteczne. Warunkiem koniecznym do zastosowania tego podejścia jest regularność cyklu miesiączkowego, co pozwoli na ustalenie optymalnego czasu aplikacji. Dodatkowa przezskórna suplementacja estrogenem w okresie przerwy w przyjmowaniu tabletek nie jest zalecana w profilaktyce migreny menstruacyjnej ze względu na brak danych.
Zgodnie z obowiązującymi wytycznymi, ciągłe stosowanie złożonych doustnych środków antykoncepcyjnych można uznać za środek zapobiegawczy. Celem jest zmniejszenie liczby cykli i wywoływanych przez nie ataków migreny. Ciągłe stosowanie przez okres do dwóch lat jest uważane za bezpieczne. Wytyczne wskazują, że ta profilaktyka bólów głowy i ataków migreny poza cyklem menstruacyjnym była dotychczas badana jedynie w otwartych badaniach bez grupy kontrolnej. Ponieważ złożone doustne środki antykoncepcyjne mogą znacząco zwiększać ryzyko udaru mózgu, a migrena z aurą sama w sobie jest czynnikiem ryzyka udaru, należy wziąć pod uwagę indywidualny profil ryzyka sercowo-naczyniowego każdej pacjentki. Zgodnie z wytycznymi, ciągłe stosowanie złożonych doustnych środków antykoncepcyjnych jest najmniej problematyczne u pacjentek z migreną bez aury i bez innych czynników ryzyka sercowo-naczyniowego. W przeciwnym razie wskazanie musi być ściśle określone, pacjentki muszą być odpowiednio poinformowane, a procedura musi być podejmowana indywidualnie w każdym przypadku. Generalnie preferowane powinny być złożone doustne środki antykoncepcyjne o niskiej zawartości estrogenu. Przeciwwskazaniem do stosowania złożonych doustnych środków antykoncepcyjnych jest bardzo aktywna migrena z aurą u pacjentek ze zwiększonym ryzykiem naczyniowym.
Odpowiednia antykoncepcja musi być również zapewniona podczas różnych terapii profilaktycznych migreny. Dotyczy to w szczególności leczenia przeciwciałami monoklonalnymi przeciwko CGRP lub receptorowi CGRP, toksyną botulinową, flunaryzyną, topiramatem i walproinianem.
Antykoncepcja hormonalna, ryzyko udaru i migrena w praktyce
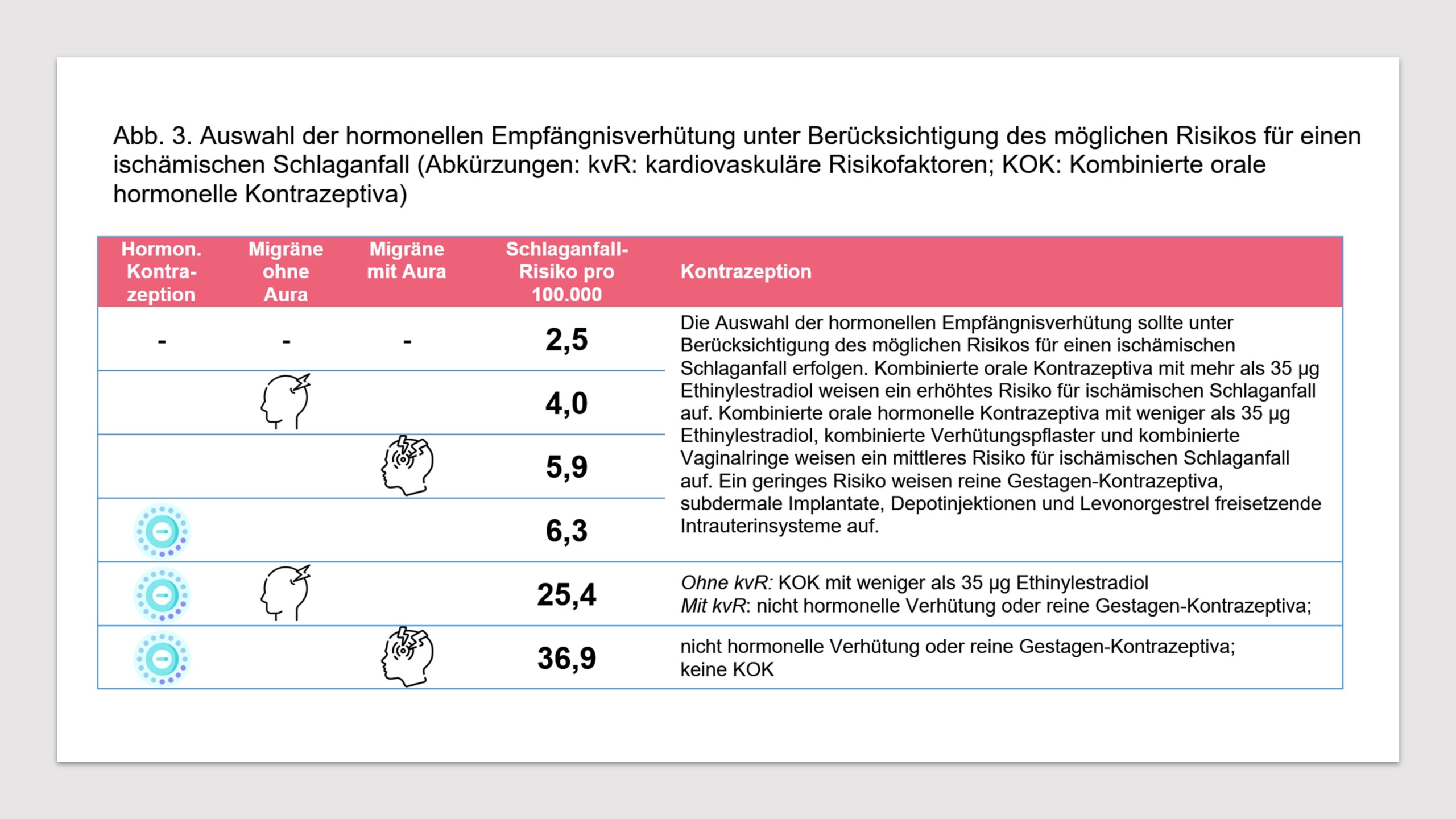
Migrena jest czynnikiem ryzyka udaru mózgu i innych zdarzeń naczyniowych. Istnieją liczne dowody na to, że zwiększone ryzyko udaru niedokrwiennego mózgu jest związane zarówno z migreną bez aury, jak i migreną z aurą [4, 30, 32, 33, 58-60]. Ponieważ ryzyko udaru mózgu może być również zwiększone w przypadku stosowania złożonych hormonalnych środków antykoncepcyjnych [4, 32, 61], pojawia się pytanie, czy współwystępowanie migreny i stosowania złożonych hormonalnych środków antykoncepcyjnych może dodatkowo zwiększać ryzyko udaru mózgu. Europejska Federacja Bólu Głowy (EHF) i Europejskie Towarzystwo Antykoncepcji i Zdrowia Reprodukcyjnego (ESCRH) analizują tę kwestię w oświadczeniu konsensusowym [33]. Bezwzględne ryzyko udaru niedokrwiennego mózgu u kobiet niestosujących antykoncepcji hormonalnej wynosi 2,5/100 000 rocznie. Takie samo ryzyko wynosi 6,3/100 000 dla kobiet stosujących hormonalne środki antykoncepcyjne. U kobiet z migreną z aurą ryzyko udaru niedokrwiennego mózgu bez stosowania antykoncepcji hormonalnej wynosi 5,9/100 000 rocznie. Ryzyko udaru niedokrwiennego mózgu z migreną z aurą i stosowaniem antykoncepcji hormonalnej wynosi 36,9/100 000 rocznie. U kobiet z migreną bez aury ryzyko udaru niedokrwiennego mózgu wynosi 4,0/100 000 rocznie. Przy stosowaniu antykoncepcji hormonalnej w tej grupie ryzyko to wynosi 25,4/100 000 rocznie (patrz ryc. 3).
Na podstawie danych Europejska Federacja Bólu Głowy (EHF) i Europejskie Towarzystwo Antykoncepcji i Zdrowia Reprodukcyjnego (ESCRH) wypracowały następujący konsensus ekspertów [33]:
- W przypadku kobiet poszukujących antykoncepcji hormonalnej zaleca się badanie kliniczne w celu ustalenia, czy występuje u nich migrena z aurą, czy bez niej. Dodatkowo, przed przepisaniem złożonych hormonalnych środków antykoncepcyjnych należy ocenić częstotliwość napadów migreny (liczba dni z bólem głowy w miesiącu) oraz zidentyfikować czynniki ryzyka naczyniowego.
- Kobietom, które chcą stosować antykoncepcję hormonalną, zaleca się korzystanie ze specjalnego narzędzia do diagnozowania migren i ich podtypów. Może to być kwestionariusz lub rozwiązanie cyfrowe, takie jak aplikacja do diagnozowania migreny (dostępna bezpłatnie pod tą nazwą w sklepach z aplikacjami).
- Wybór hormonalnej antykoncepcji powinien być dokonany z uwzględnieniem potencjalnego ryzyka udaru niedokrwiennego. Doustne środki antykoncepcyjne złożone zawierające ponad 35 µg etynyloestradiolu niosą ze sobą zwiększone ryzyko udaru niedokrwiennego. Doustne środki antykoncepcyjne złożone zawierające mniej niż 35 µg etynyloestradiolu, plastry antykoncepcyjne złożone i pierścienie dopochwowe złożone niosą ze sobą umiarkowane ryzyko udaru niedokrwiennego. Środki antykoncepcyjne zawierające wyłącznie progestagen, implanty podskórne, zastrzyki depot oraz systemy domaciczne uwalniające lewonorgestrel niosą ze sobą niskie ryzyko.
- Kobietom cierpiącym na migrenę z aurą, które chcą stosować antykoncepcję hormonalną, odradza się przepisywanie złożonych hormonalnych środków antykoncepcyjnych.
- Kobietom cierpiącym na migrenę z aurą, które chcą stosować antykoncepcję, zaleca się stosowanie metod niehormonalnych (prezerwatyw, wkładek wewnątrzmacicznych z miedzią lub środków antykoncepcyjnych zawierających wyłącznie progestagen) jako opcji preferowanej. W przypadku migreny z aurą i stosowania złożonych hormonalnych środków antykoncepcyjnych zaleca się przejście na antykoncepcję niehormonalną lub wyłącznie progestagenową.
- Kobietom cierpiącym na migrenę bez aury, które chcą stosować antykoncepcję hormonalną, ale mają dodatkowe czynniki ryzyka (palenie tytoniu, nadciśnienie tętnicze, otyłość, choroby układu sercowo-naczyniowego, zakrzepicę żył głębokich lub zatorowość płucną w przeszłości), zaleca się jako opcję preferowaną antykoncepcję niehormonalną lub antykoncepcję zawierającą wyłącznie progestagen.
- W przypadku kobiet cierpiących na migrenę bez aury, stosujących antykoncepcję hormonalną i bez dodatkowych czynników ryzyka, zaleca się stosowanie antykoncepcji hormonalnej w dawce mniejszej niż 35 µg etynyloestradiolu. Jednocześnie należy monitorować częstotliwość i charakter migreny.
- Jeśli kobiety cierpią na migrenę z aurą lub migrenę bez aury i wymagają leczenia hormonalnego z powodu zespołu policystycznych jajników lub endometriozy, zaleca się stosowanie leczenia hormonalnego wyłącznie progestagenami lub złożonych hormonalnych środków antykoncepcyjnych, zgodnie z uwarunkowaniami klinicznymi.
- Jeśli u kobiet, które rozpoczną stosowanie złożonych hormonalnych środków antykoncepcyjnych, wystąpi nowa migrena z aurą lub migrena bez aury po raz pierwszy w bliskim związku czasowym z rozpoczęciem stosowania hormonalnych środków antykoncepcyjnych, zaleca się przejście na niehormonalne środki antykoncepcyjne lub środki antykoncepcyjne zawierające wyłącznie progestagen.
- U kobiet cierpiących na migrenę z aurą lub bez aury, wymagających antykoncepcji awaryjnej, zaleca się zastosowanie lewonorgestrelu 1,5 mg doustnie, octanu uliprystalu 30 mg doustnie lub wkładki domacicznej zawierającej miedź.
- U kobiet cierpiących na migrenę z aurą lub bez aury rozpoczynających stosowanie antykoncepcji hormonalnej, konkretne badania, takie jak badanie przesiewowe w kierunku trombofilii, badanie drożnego otworu owalnego lub badania obrazowe, nie mają znaczenia dla decyzji o stosowaniu antykoncepcji hormonalnej, chyba że historia choroby lub wyniki badań wymagają takich badań ze względu na szczególne wskazania.
- Kobiety z bólami głowy innymi niż migrena, które chcą stosować antykoncepcję hormonalną, mogą stosować dowolne środki antykoncepcyjne o małej dawce hormonów.
Ogólnie rzecz biorąc, dowody dotyczące związku między udarem niedokrwiennym mózgu a stosowaniem antykoncepcji hormonalnej są ograniczone. Istnieją zasadniczo jedynie niekontrolowane badania obserwacyjne. Konieczne są dalsze badania w celu dokładniejszego określenia potencjalnego ryzyka związanego ze stosowaniem antykoncepcji hormonalnej u kobiet z migreną. Niemniej jednak, obecne dane wskazują na zwiększone ryzyko udaru niedokrwiennego mózgu związane ze stosowaniem antykoncepcji hormonalnej u kobiet z migreną. W tej sytuacji niezwykle ważne jest, aby podczas stosowania antykoncepcji hormonalnej zwracać szczególną uwagę na kwestie bezpieczeństwa. Nawet jeśli bezwzględne ryzyko udaru mózgu nie jest bardzo wysokie, udar może mieć katastrofalne skutki dla pacjentów i ich rodzin. Z tych powodów, w przypadku odpowiednio zwiększonego ryzyka, należy rozważyć alternatywne metody antykoncepcji.
literatura
- Komitet Klasyfikacji Bólów Głowy Międzynarodowego Towarzystwa Bólów Głowy (IHS), Międzynarodowa Klasyfikacja Bólów Głowy ICHD-3, wydanie 3. Cephalalgia, 2018. 38 (1): s. 1-211.
- Klasyfikacja i kryteria diagnostyczne bólów głowy, nerwobólów czaszkowych i bólu twarzy. Komitet Klasyfikacji Bólów Głowy Międzynarodowego Towarzystwa Bólów Głowy. Cephalalgia, 1988. 8 Suppl 7 : s. 1-96.
- Międzynarodowa Klasyfikacja Zaburzeń Bólu Głowy: wydanie 2. Cephalalgia, 2004. 24 Suppl 1 : s. 9-160.
- Nappi, RE i in., Rola estrogenów w migrenie menstruacyjnej. Cells, 2022. 11 (8).
- Russell, MB, Genetyka migreny menstruacyjnej: dowody epidemiologiczne. Curr Pain Headache Rep, 2010. 14 (5): s. 385-8.
- Somerville, BW, Rola odstawienia estradiolu w etiologii migreny menstruacyjnej. Neurology, 1972. 22 (4): s. 355-65.
- Pavlović, JM i wsp., Hormony płciowe u kobiet z migreną i bez migreny. Neurology, 2016. 87 (1): s. 49.
- Cornil, CA, GF Ball i J. Balthazart, Funkcjonalne znaczenie szybkiej regulacji działania estrogenów w mózgu: skąd pochodzą estrogeny? Brain Res, 2006. 1126 (1): s. 2-26.
- Boese, AC i in., Różnice płciowe w fizjologii i patofizjologii naczyń: sygnalizacja estrogenowa i androgenowa w zdrowiu i chorobie. Am J Physiol Heart Circ Physiol, 2017. 313 (3): s. H524-h545.
- Rodriguez-Acevedo, AJ i in., Badania powiązań genetycznych i ekspresji genów sugerują, że warianty genetyczne w genach SYNE1 i TNF są powiązane z migreną menstruacyjną. J Headache Pain, 2014. 15 (1): s. 62.
- Vetvik, KG i EA MacGregor, Migrena menstruacyjna: odrębne schorzenie wymagające szerszego rozpoznania. Lancet Neurol, 2021. 20 (4): s. 304-315.
- Shughrue, PJ i I. Merchenthaler, Estrogen to coś więcej niż tylko „hormon płciowy”: nowe miejsca działania estrogenu w hipokampie i korze mózgowej. Front Neuroendocrinol, 2000. 21 (1): s. 95-101.
- Facchinetti, F. i wsp., Neuroendokrynna ocena centralnej aktywności opioidowej w pierwotnych bólach głowy. Pain, 1988. 34 (1): s. 29-33.
- Tassorelli, C. i in., Zmiany progu odruchu zgięciowego receptorów bólowych w trakcie cyklu menstruacyjnego u zdrowych kobiet. Psychosom Med, 2002. 64 (4): s. 621-6.
- Krause, DN i wsp., Wpływ hormonów na migrenę – interakcje estrogenu, oksytocyny i CGRP. Nat Rev Neurol, 2021. 17 (10): s. 621-633.
- De Icco, R. i in., Modulacja progu nocyceptywnego przez złożone środki antykoncepcyjne hormonalne u kobiet z napadami migreny po odstawieniu estrogenu: badanie pilotażowe. J Headache Pain, 2016. 17 (1): s. 70.
- Warfvinge, K. i wsp., Receptory estrogenowe α, β i GPER w ośrodkowym układzie nerwowym i układzie trójdzielnym – aspekty molekularne i funkcjonalne. J Headache Pain, 2020. 21 (1): s. 131.
- Kitazawa, T. i in., Niegenomowy mechanizm hamowania skurczu mięśni gładkich naczyń krwionośnych ssaków wywołanego 17 beta-estradiolem. J Physiol, 1997. 499 (część 2) (część 2): s. 497-511.
- Somjen, GG, Mechanizmy rozprzestrzeniającej się depresji i rozprzestrzeniającej się hipoksemicznej depolaryzacji przypominającej depresję. Physiol Rev, 2001. 81 (3): s. 1065-96.
- Edvinsson, L. i in., CGRP jako cel nowych terapii migreny – udane przeniesienie z laboratorium do kliniki. Nat Rev Neurol, 2018. 14 (6): s. 338-350.
- Knight, YE, L. Edvinsson i PJ Goadsby, 4991W93 hamuje uwalnianie peptydu związanego z genem kalcytoniny u kotów, ale tylko w dawkach wykazujących aktywność agonistyczną receptora 5HT(1B/1D)? Neuropharmacology, 2001. 40 (4): s. 520-5.
- Ashina, M., Migrena. N Engl J Med, 2020. 383 (19): s. 1866-1876.
- Forbes, RB, M. McCarron i CR Cardwell, Skuteczność i kontekstowe (placebo) efekty przeciwciał CGRP w leczeniu migreny: przegląd systematyczny i metaanaliza. Headache, 2020. 60 (8): s. 1542-1557.
- Drellia, K. i in., Przeciwciała monoklonalne anty-CGRP w profilaktyce migreny: przegląd systematyczny i analiza prawdopodobieństwa skuteczności lub szkodliwości. Cephalalgia, 2021. 41 (7): s. 851-864.
- Valdemarsson, S. i in., Wpływ hormonów na peptyd związany z genem kalcytoniny u mężczyzn: wpływ różnic płciowych i tabletek antykoncepcyjnych. Scand J Clin Lab Invest, 1990. 50 (4): s. 385-8.
- Gupta, P. i in., Wpływ menopauzy na krążący peptyd związany z genem kalcytoniny i adipokiny: implikacje dla insulinooporności i ryzyka sercowo-naczyniowego. Climacteric, 2008. 11 (5): s. 364-72.
- Aggarwal, M., V. Puri i S. Puri, Wpływ estrogenu na układ serotoninergiczny i peptyd związany z genem kalcytoniny w zwojach nerwu trójdzielnego u szczurów. Ann Neurosci, 2012. 19 (4): s. 151-7.
- Cetinkaya, A. i in., Wpływ estrogenu i progesteronu na neurogenne neuropeptydy zapalne: implikacje dla różnic płciowych w migrenie. Exp Brain Res, 2020. 238 (11): s. 2625-2639.
- Yamanaka, G. i in., Rola neurozapalenia i permutacji bariery krew-mózg w migrenie. Int J Mol Sci, 2021. 22 (16).
- Cupini, LM, I. Corbelli i P. Sarchelli, Migrena menstruacyjna: czym jest i czy ma znaczenie? J Neurol, 2021. 268 (7): s. 2355-2363.
- MacGregor, EA i wsp., Częstość występowania migreny w zależności od faz cyklu menstruacyjnego, w których stężenie estrogenu rośnie i spada. Neurology, 2006. 67 (12): s. 2154-8.
- Sacco, S. i in., Wpływ estrogenów i progestagenów egzogennych na przebieg migreny w wieku rozrodczym: stanowisko konsensusu Europejskiej Federacji Bólu Głowy (EHF) i Europejskiego Towarzystwa Antykoncepcji i Zdrowia Reprodukcyjnego (ESCRH). J Headache Pain, 2018. 19 (1): s. 76.
- Sacco, S. i in., Hormonalne środki antykoncepcyjne a ryzyko udaru niedokrwiennego mózgu u kobiet z migreną: stanowisko konsensusu Europejskiej Federacji Bólu Głowy (EHF) i Europejskiego Towarzystwa Antykoncepcji i Zdrowia Reprodukcyjnego (ESC). J Headache Pain, 2017. 18 (1): s. 108.
- Merki-Feld, GS i in., Poprawa w przebiegu migreny po przejściu ze złożonych hormonalnych środków antykoncepcyjnych na antykoncepcję wyłącznie progestagenową z dezogestrelem: Jak silny jest efekt odstawienia złożonych środków antykoncepcyjnych u kobiet? J Obstet Gynaecol, 2017. 37 (3): s. 338–341.
- Morotti, M. i wsp., Tabletka antykoncepcyjna zawierająca wyłącznie progestagen w porównaniu z doustną antykoncepcją złożoną w leczeniu objawów bólowych wywołanych endometriozą u pacjentek z migreną bez aury. Eur J Obstet Gynecol Reprod Biol, 2014. 179 : s. 63-8.
- Morotti, M. i wsp., Antykoncepcja wyłącznie progestagenowa w porównaniu z przedłużonym stosowaniem złożonej doustnej antykoncepcji u kobiet z migreną bez aury: retrospektywne badanie pilotażowe. Eur J Obstet Gynecol Reprod Biol, 2014. 183 : s. 178-82.
- Nappi, RE i in., Wpływ doustnej antykoncepcji bez estrogenu, zawierającej dezogestrel, u kobiet z migreną z aurą: prospektywne badanie pilotażowe oparte na dziennikach. Contraception, 2011. 83 (3): s. 223-8.
- Coffee, AL i in., Doustne środki antykoncepcyjne o przedłużonym cyklu i profilaktyczny frowatryptan w okresie bezhormonalnym u kobiet z migrenami związanymi z miesiączką. J Womens Health (Larchmt), 2014. 23 (4): s. 310-7.
- Calhoun, AH, Nowa, specyficzna profilaktyka migreny związanej z miesiączką. South Med J, 2004. 97 (9): s. 819-22.
- Macgregor, EA i A. Hackshaw, Zapobieganie migrenie w okresie przerwy w przyjmowaniu złożonych doustnych środków antykoncepcyjnych: podwójnie ślepe, kontrolowane placebo badanie pilotażowe z zastosowaniem naturalnych suplementów estrogenowych. J Fam Plann Reprod Health Care, 2002. 28 (1): s. 27-31.
- LaGuardia, KD i in., Hamowanie bólu głowy wywołanego odstawieniem estrogenu za pomocą przedłużonej antykoncepcji przezskórnej. Fertil Steril, 2005. 83 (6): s. 1875-7.
- Calhoun, A., S. Ford i A. Pruitt, Wpływ antykoncepcji dopochwowej o przedłużonym cyklu na aurę migrenową: retrospektywna seria przypadków. Headache, 2012. 52 (8): s. 1246-53.
- de Lignières, B. i wsp., Zapobieganie migrenom menstruacyjnym przez przezskórny estradiol. Br Med J (Clin Res Ed), 1986. 293 (6561): s. 2. 1540.
- Dennerstein, L. i in., Migrena menstruacyjna: podwójnie ślepa próba przezskórnego podawania estradiolu. Gynecol Endocrinol, 1988. 2 (2): s. 113-20.
- MacGregor, EA i wsp., Zapobieganie napadom migreny menstruacyjnej: badanie krzyżowe z podwójnie ślepą próbą, kontrolowane placebo. Neurology, 2006. 67 (12): s. 2159-63.
- Martin, V. i in., Medyczna ooforektomia z terapią uzupełniającą estrogenami i bez niej w zapobieganiu migrenie. Ból głowy, 2003. 43 (4): s. 309-21.
- Magos, AL, KJ Zilkha i JW Studd, Leczenie migreny menstruacyjnej za pomocą implantów estradiolu. J Neurol Neurosurg Psychiatry, 1983. 46 (11): s. 1044-6.
- Murray, SC i KN Muse, Skuteczne leczenie silnych migren menstruacyjnych agonistą hormonu uwalniającego gonadotropinę i terapią „add-back”. Fertil Steril, 1997. 67 (2): s. 390-3.
- Ferrante, F. i in., Fitoestrogeny w profilaktyce migreny menstruacyjnej. Clin Neuropharmacol, 2004. 27 (3): s. 137-40.
- Burke, BE, RD Olson i BJ Cusack, Randomizowane, kontrolowane badanie fitoestrogenów w profilaktycznym leczeniu migreny menstruacyjnej. Biomed Pharmacother, 2002. 56 (6): s. 283-8.
- Eikermann-Haerter, K. i in., Androgenowe hamowanie rozprzestrzeniającej się depresji u myszy z mutacją rodzinnej migreny hemiplegicznej typu 1. Ann Neurol, 2009. 66 (4): s. 564-8.
- Nappi, RE, K. Wawra i S. Schmitt, Zaburzenia hipoaktywnego popędu seksualnego u kobiet po menopauzie. Gynecol Endocrinol, 2006. 22 (6): s. 318-23.
- MacGregor, EA, Migrena menstruacyjna i okołomenopauzalna: przegląd narracyjny. Maturitas, 2020. 142 : s. 24-30.
- Schoretsanitis, G. i in., Interakcje leków psychotropowych z doustnymi środkami antykoncepcyjnymi. Opinia eksperta Drug Metab Toxicol, 2022. 18 (6): s. 395-411.
- Lazorwitz, A. i in., Wpływ topiramatu na stężenie etonogestrelu w surowicy u użytkowniczek implantów antykoncepcyjnych. Obstet Gynecol, 2022. 139 (4): s. 579-587.
- Ornello, R. i wsp., Ból głowy menstruacyjny u kobiet z przewlekłą migreną leczonych erenumabem: seria przypadków obserwacyjnych. Brain Sci, 2021. 11 (3).
- Pavlovic, JM i wsp., Skuteczność i bezpieczeństwo erenumabu u kobiet z historią migreny menstruacyjnej. J Headache Pain, 2020. 21 (1): s. 95.
- Adewuyi, EO i in., Wspólne mechanizmy molekularne i genetyczne leżą u podstaw współwystępowania endometriozy i migreny. Genes (Bazylea), 2020. 11 (3).
- Saddik, SE i in., Ryzyko udaru mózgu u kobiet cierpiących na migrenę – ukryty związek: przegląd systematyczny. Cureus, 2022. 14 (7): s. e27103.
- Siao, WZ i in., Ryzyko choroby tętnic obwodowych i udaru mózgu u osób z migreną z aurą lub bez aury: ogólnopolskie badanie kohortowe populacyjne. Int J Med Sci, 2022. 19 (7): s. 1163-1172.
- Champaloux, SW i wsp., Stosowanie złożonych hormonalnych środków antykoncepcyjnych u kobiet z migrenami i ryzykiem udaru niedokrwiennego mózgu. Am J Obstet Gynecol, 2017. 216 (5): s. 489.e1-489.e7.
- Wytyczne dotyczące antykoncepcji hormonalnej DGGG, SGGG i OEGGG (poziom S3, rejestr AWMF nr 015/015, listopad 2019 r.). https://register.awmf.org/de/leitlinien/detail/015-015.
- Diener, H.-C. i in., Terapia ataków migreny i profilaktyka migreny, wytyczne S1, 2022, DGN i DMKG , w: Wytyczne dotyczące diagnostyki i terapii w neurologii , DGfN (red.), Redaktor. 2022: Online: www.dgn.org/leitlinien .
Pobierz publikację PDF Pain Medicine 02 2023










zostaw komentarz