Siedemdziesiąt pięć lat temu wykazano, że duże naczynia krwionośne tętnicze i żylne w oponach mózgowych są wrażliwe na ból – w przeciwieństwie do samej tkanki mózgowej. Dwadzieścia pięć lat temu zidentyfikowano neuropeptydy, czyli białka uwalniane z włókien nerwowych, które regulują średnicę tych naczyń krwionośnych. Jedną z tych substancji był CGRP ( peptyd związany z genem kalcytoniny ). CGRP należy do najsilniejszych wazodylatatorów w organizmie. Jednocześnie, jak wykazały badania eksperymentalne, rozszerzeniu naczyń krwionośnych związanemu z CGRP towarzyszy ból.
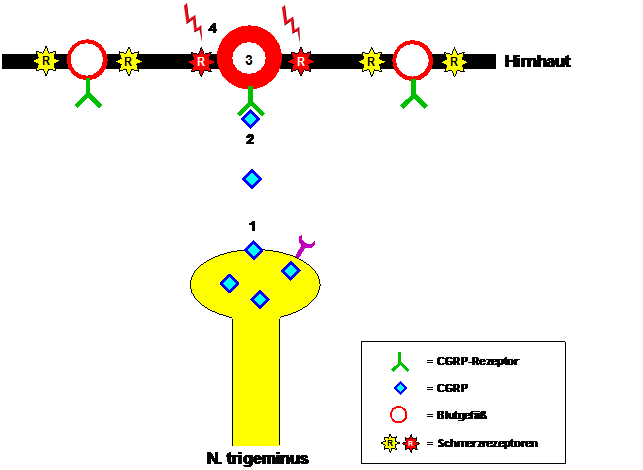
Kluczowa rola CGRP w rozwoju migreny stała się oczywista, gdy stwierdzono podwyższone poziomy CGRP we krwi żylnej pacjentów doświadczających ataków migreny. Poziomy te normalizowały się po ustąpieniu migreny po podaniu sumatryptanu. Obserwacje te potwierdzono, gdy ataki migreny u pacjentów można było wywołać poprzez infuzję CGRP. CGRP jest produkowany między innymi we włóknach nerwowych nerwu trójdzielnego i uwalniany, gdy włókna te są aktywowane podczas ataku migreny (patrz rycina 1). Uwolniony CGRP wiąże się z receptorami CGRP w ścianach naczyń krwionośnych opon mózgowo-rdzeniowych. Prowadzi to do rozszerzenia naczyń krwionośnych i jednocześnie do uwrażliwienia receptorów bólowych w ścianach naczyń krwionośnych. Pulsowanie rozszerzonych naczyń krwionośnych staje się bodźcem bólowym, który pacjenci odczuwają jako pulsujący, pulsujący ból migrenowy, nasilający się przy każdym wysiłku fizycznym, często nawet przy samym schylaniu się.
Rycina 1: Mediacja bólu migrenowego przez CGRP. Podczas ataku migreny CGRP (1) uwalniany jest z włókien nerwu trójdzielnego, wiąże się z receptorem CGRP (2), wywołuje rozszerzenie naczyń krwionośnych w oponach mózgowych (3) i ostatecznie prowadzi do uwrażliwienia receptorów bólowych (4), które reagują na pulsowanie sąsiadujących naczyń krwionośnych, wywołując uczucie pulsującego bólu migrenowego.
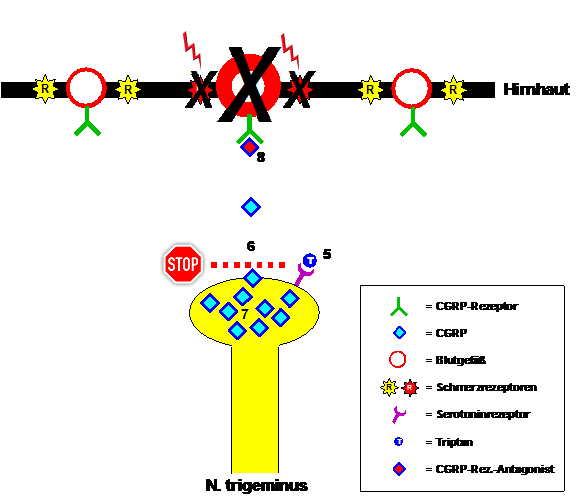
Tryptany wiążą się ze specyficznymi receptorami serotoninowymi znajdującymi się na zakończeniach włókien nerwu trójdzielnego i hamują uwalnianie CGRP podczas ataku migreny. Rozkład uwolnionego wcześniej CGRP, ponowne zwężenie naczyń krwionośnych i przywrócenie prawidłowej (nie)wrażliwości receptorów bólowych zajmuje trochę czasu. Następnie, u pacjenta, migrena zostaje tymczasowo przerwana. To jasno pokazuje, że tryptany, jak każdy inny lek, działają szybciej i skuteczniej, im wcześniej zostaną zażyte w trakcie ataku i im mniej CGRP zostało już uwolnione. Okazuje się jednak również, że tryptany nie kończą ataków migreny. CGRP jest nadal produkowany, ale jego uwalnianie jest tymczasowo zahamowane. CGRP kumuluje się we włóknach nerwu trójdzielnego, czekając na metabolizm tryptanów. Późniejsze, a czasami znaczne, uwolnienie CGRP prowadzi do nawrotu bólu migrenowego u pacjentów, tzw. bólu głowy z odbicia. Zazwyczaj ponowne zażycie tryptanu jest wtedy skuteczne. Cykl ten powtarza się aż do ustąpienia ataku migreny, zazwyczaj po 4 do 72 godzinach. Alternatywą dla tryptanów były leki, które kilka lat temu testowano, a nie blokowały uwalniania CGRP, lecz sam receptor CGRP. Uwolniony CGRP nie znalazł zatem celu w atakach migreny. Te antagoniści receptora CGRP były równie skuteczne jak tryptany, ale niestety regularne stosowanie w wyższych dawkach prowadziło do uszkodzenia wątroby, dlatego nigdy nie trafiły na rynek.
Rycina 2: Leczenie napadów migreny tryptanami i antagonistami receptora CGRP. Tryptany wiążą się z receptorami serotoninowymi na zakończeniach nerwu trójdzielnego (5) i tym samym hamują uwalnianie CGRP (6). Objawy migreny zależnej od CGRP ustępują. Ten sam efekt można osiągnąć, blokując receptor CGRP za pomocą antagonisty receptora CGRP (8). Problem z tryptanami polega na tym, że – nawet gdy migrena wydaje się ustąpić – CGRP nadal jest produkowany (7) i uwalniany po ustąpieniu działania tryptanów. Prowadzi to do nawracających bólów głowy.
Wprowadzenie tryptanów było niewątpliwie przełomowym postępem w napadów . Jak dotąd nie osiągnięto podobnego sukcesu w profilaktyce migreny opracowany . Wszystkie te leki były początkowo stosowane w leczeniu innych schorzeń, na przykład beta-blokerów w leczeniu nadciśnienia tętniczego, i charakteryzują się mniej lub bardziej niekorzystnym stosunkiem korzyści do ryzyka. Oczekuje się, że sytuacja ta ulegnie zmianie w przyszłości, a CGRP ponownie odegra decydującą rolę.
Trwają badania kliniczne z udziałem Kliniki Leczenia Bólu w Kiel, przeciwciał monoklonalnych w profilaktyce migreny. Przeciwciała te albo niszczą CGRP, białko uwalniane podczas ataków migreny, albo celują w receptor CGRP. Pacjenci są zasadniczo biernie szczepieni przeciwko migrenom. Przeciwciała podaje się podskórnie raz w miesiącu. Wstępne wyniki badań są obiecujące – substancje są znacznie skuteczniejsze niż placebo i jak dotąd dobrze tolerowane. Szczególnie obiecujący na przyszłość jest jednak fakt, że niewielka grupa pacjentów w opublikowanych badaniach fazy II całkowicie uwolniła się od ataków migreny. Czas pokaże, czy wyniki te zostaną potwierdzone i, co ważniejsze, czy efekty będą trwałe.
Rycina 3: Cel działania przeciwciał monoklonalnych w profilaktyce migreny. Przeciwciała są wstrzykiwane podskórnie raz w miesiącu, a następnie niszczą CGRP (9) uwalniany podczas napadów migreny lub receptor CGRP (10). Teoretycznie powinno to zapobiec bezbolesności napadów migreny dzięki eliminacji działania CGRP.
Dr Axel Heinze, dr Katja Heinze-Kuhn, prof. dr Hartmut Göbel, Kiel Pain Clinic
Dodatek: Wielu czytelników pytało o udział w badaniu. Projekt ma szczegółowe kryteria uczestnictwa, które musimy indywidualnie zweryfikować. Jest to badanie międzynarodowe. Aby zapewnić globalną porównywalność wyników, każdy ośrodek może wybrać tylko ograniczoną liczbę uczestników. Zazwyczaj wymaga to dłuższego okresu leczenia w naszej placówce ambulatoryjnej.










Zgadzam się, że od wielu lat cierpię na migreny, które nie przestają. Czasem nic nie pomaga i trzeba nawet wzywać pogotowie. Ja też chciałabym się zaszczepić i mam nadzieję, że to kiedyś minie.
Od 18 roku życia cierpię na migreny.
Dziś mam 59 lat i próbowałam wielu rzeczy – chwytając się każdej słomki. Jednak poczułem się też trochę zniechęcony z powodu wielu nieudanych prób. Aktualnie leczę się botoksem. Oznacza to, że przeszedłem od co najmniej 15 do 20 dni bólu w miesiącu do średnio 12–15 dni trudności. To niewielka ulga. Sytuacja się pogarsza, gdy 10 tryptanów na miesiąc zostaje „wyczerpanych” i muszę znosić ból przez resztę miesiąca. Czasem mam wrażenie, że walczę przez życie. Szczepienie przeciwko migrenom – o którym mówił mi już mój neurolog – byłoby fantastyczne i stanowiłoby szansę na lepszą jakość życia tak wielu osób.
Jeśli będą prowadzone dalsze studia w Niemczech i będą poszukiwane kierunki na nie... bardzo chętnie wezmę w nich udział.
Ja również cierpię na migreny od ponad 30 lat, czasami z aurą, a zazwyczaj bez aury. To tortura i wpędza w depresję. Nie da się niczego dobrze zaplanować, trudno nadążyć za pracą. Przychodzi na czas nieokreślony. Oznacza to, że nie radzisz sobie ze stresem dnia codziennego. Zrozumienie można znaleźć tylko wśród ludzi o podobnych poglądach. Ja również oddałabym się w tym celu poprzez szczepienie, aby życie w końcu znów stało się bardziej wartościowe.
Byłbym również dostępny jako obiekt testowy w tym badaniu!!!!
Z powodu mojej zmiany mam też dużo więcej ataków i zdiagnozowaną migrenę z zawrotami głowy. Nawet jeden dzień mniej bez migreny to dzień zyskany. Oby spełniło się także moje największe i najgorętsze życzenie.
Na migrenę cierpię od 40 lat i jej częstotliwość wzrasta z roku na rok - około 20 razy w miesiącu - ból bierzesz na siebie omdleniami, cierpi na to Twoja rodzina, przyjaciele i współpracownicy.
Kiedy podczas wizyty zobaczyłam relację, prawie się popłakałam, bo liczyłam na bezbolesną przyszłość, gdybym jak wiele osób tutaj mogła od razu
wziąć udział w charakterze osoby testującej.
Czy są jeszcze cuda??
Ja również wzięłabym udział w badaniu od razu... Mam 30 dni bólowych w miesiącu -.-
Bardzo chciałbym wziąć udział w tym badaniu.
Od dziecka cierpię na migreny.
Każda terapia była dla mnie nieskuteczna. Moje migreny są bardzo silne, ponieważ żadne leki już nie pomagają. Często leżę w łóżku i czuję się bezsilna i cierpi na tym każdy członek mojej rodziny.Może ten zabieg byłby dla mnie i mojej rodziny ulgą! Pozdrawiam z Frankfurtu!
Bardzo zazdroszczę Twoich komentarzy o.0 Mam to zdiagnozowane od 5-6 roku życia i mam migreny do 25 dni w miesiącu... Ja też bardzo czekam na leki i zrobiłabym to cokolwiek, żeby mieć spokój ducha... Po prostu odraczam operację z rurkami ze względu na leki... Ale 5 razy w miesiącu to prawie dobry wynik oO
Na migrenę cierpię już 38 lat. Żyję z tym dłużej w życiu niż bez niego. Nie potrafię nawet wymienić tego, co zrobiłem, ale chwytałem się słomki. Bezskutecznie. Nienawidzę tego, jak migreny przejmują kontrolę nad moim/naszym życiem. W końcu zawsze uciekasz się do tryptanów, aby móc pracować i w pewnym stopniu uczestniczyć w życiu. Szczepienie, nie mogę w to uwierzyć, byłoby dla mnie najwspanialszym prezentem po tak długim czasie.
Zgadzam się z komentarzami moich poprzedników. Po dziesięcioleciach bólu i licznych terapiach ta terapia/szczepienie przyniesie ulgę. Wszyscy borykamy się z problemami i wszyscy potrzebujemy leczenia, które przywróci nam jakość życia. Poruszamy się z dnia na dzień, z tygodnia na tydzień, a każda minuta naszego życia jest przyćmiona migreną. Cierpi psychika, dusza i ciało. Każdy z nas zasługuje na medal za osiągnięcia, które osiąga pomimo bólu. Również osobom, które w naszym imieniu badają migreny. Dzięki.
Ja też bym tam była – mając 14 lat – i jak powiedziałam – nikt by nie uwierzył, jak to wpłynie na codzienne życie.
Nikt nie ocenia tylko pacjenta, który cierpi – dzieci, partnerów, kolegów
Zapłaciłabym za szczepienie od razu, bo od 35 lat cierpię na migreny z aurą, a od około roku, kiedy przeszłam menopauzę, z każdym miesiącem mam ataki znacznie częściej.
Ja też bym tam od razu był. To niewyobrażalne, aby po kilku latach cierpieć na migreny, znów być wolnym. Po prostu żyj i ciesz się dniem.
Bez bólu przez ponad 350 dni w roku? To brzmi zbyt dobrze, aby mogło być prawdziwe!!!!!!!!!!!
To byłby sen !!! Po prawie 30 latach i 4-5 razy w miesiącu migreny w końcu bez bólu !!! Byłbym również gotowy na badanie natychmiast.
Bezbolesne, co za miłe słowo………
Od 17 roku życia cierpię na bardzo silne migreny.
Mam teraz 56 lat i od 3 dni z rzędu mam migreny. Dostaję 18 tabletek na migrenę Maxalt i 4 zastrzyki Imigranu co kwartał, dzięki czemu życie codzienne staje się dla mnie bardziej znośne. Byłbym również szczęśliwy, mogąc w końcu pozbyć się nieznośnych ataków, udostępniając się jako obiekt testów. Moim marzeniem byłoby wreszcie uwolnić się od bólu i po prostu znowu wziąć udział w życiu.
Drodzy klinicyści,
perspektywa mniejszego bólu po około 60 latach graniczy z rajskimi warunkami.
Podobnie jak wielu innych, od razu zgłosiłbym się jako osoba testowa. Może to zadziała. Wszystkiego najlepszego dla nas, innych cierpiących,
Gunnara Thiema
To brzmi jak bajka, byłaby rewolucja, jedno szczepienie w miesiącu i wszystko byłoby w porządku…
Chciałbym także szczepić się co tydzień, o ile nie muszę się już martwić atakiem migreny!!!!! Możliwość ponownego cieszenia się życiem, bez wyrzutów sumienia wobec kolegów i i i...,,,,,! Bardzo chciałbym tam być!!!!!!
Ja również od razu zgłosiłbym się jako kandydat! Ja też mam migreny odkąd pamiętam i wydaje mi się, że jestem coraz bardziej wrażliwa, a raczej migreny pojawiają się coraz częściej, pozornie bez powodu! Wypróbowałem całą profilaktykę migreny i znowu wszystko przerwałem, bo po prostu nie zadziałało. Jak więc możesz wziąć udział w badaniu? Komentarze zaczną się 15 marca? Dzisiaj, kiedy wszedłem na tę stronę, bo znowu mam migreny, jest 19 września 2016 roku!
Ja też zaraz tam będę! Życie bez bólu brzmi aż za dobrze...
Jestem również bardzo zainteresowany uczestnictwem w charakterze osoby testowej i ucieczką z błędnego koła
Szanowny Panie Profesorze Hartmut Göbel, drodzy doktorowie Axel Heinze i Katja Heinze-Kuhn,
Zgadzam się z wieloma nadziejami wyrażanymi przez komentatorów. Czy mogę zasugerować Twoje bardzo interesujące i pouczające wypowiedzi? W artykule omówiono m.in. wyniki opublikowanych badań II fazy. Byłbym bardzo zainteresowany proponowanym harmonogramem dalszego planowania (faza III, data ukończenia dokumentacji zatwierdzającej, przewidywana data zatwierdzenia).
Z moich ustaleń wynika, że nadzieja odgrywa dużą rolę w leczeniu migreny. Na przykład poprawę uzyskano także w grupie testowej, która otrzymała jedynie zastrzyk placebo. Mam 59 lat i biorę średnio od 8 do 10 tryptanów miesięcznie. Ponieważ te środki nie są już tak popularne po około 65 roku życia, oczywiście już myślę o tym, co będzie za kilka lat. W tej chwili nie ma dla mnie realnej alternatywy dla tryptanów. To już sprawia, że myśl o tym, że za kilka lat nie będzie już można przyjmować tych leków, staje się dręczącą myślą. Dlatego dla mnie (i myślę, że wypowiadam się tutaj w imieniu wielu komentatorów) harmonogram dalszego planowania jest bardzo interesujący. Kto wie, może już sama konkretna perspektywa pomocy – choćby jeszcze w przyszłości – pomoże poprawić sytuację już dziś. Nie mogę tego dla siebie wykluczyć. Nie bez powodu mówi się: „Nadzieja umiera ostatnia”.
Pozdrawiam i życzę powodzenia
Oglądałam wczoraj wizytę NDR i zobaczyłam, że teraz powinna być szczepionka na migrenę.Zaszczepiłabym się od razu, bo od menopauzy z wielkim smutkiem cierpię na migreny prawie codziennie. Czasem są one słabsze, czasem silniejsze. , ale one są zawsze. Powoli zanikają. Moje siły i jakość życia są tak mocno ograniczone, że czasami już mi się nie chce. Mam 56 lat i zastanawiam się, co będzie dalej. Jeśli był taki lek, byłoby wspaniale. Szkoda, że my, normalni obywatele, musimy to robić. Zawsze dowiaduję się o tym za późno. Marzeniem byłoby znów być bez bólu i słabości. Będę po raz pierwszy zostałam babcią i bardzo mi smutno, że nie będę na to zdrowa
Szanowny Profesorze Göbel,
Ze swojej strony życzę Tobie i innym lekarzom biorącym udział w programie wielu, wielu sukcesów. Byłaby to rewolucja w terapii migreny. Nie mogę się tego doczekać.
Serdecznie pozdrawiam,
S. Ritter
To niewiarygodne, jak wiele osób doświadcza tego samego, a mimo to w życiu codziennym rzadko spotyka się ludzi o podobnych poglądach! Po 30 latach migreny i wszystkich możliwych metod leczenia i leków, które nigdy nie zadziałały, to badanie daje mi niesamowitą nadzieję! Mam małego synka od 9 miesięcy i jak możesz sobie wyobrazić, dziecko i migrena to najgorsza kombinacja, jaka może być. Naprawdę mam nadzieję, że pewnego dnia nie będę już musiała bać się ataków i będę mogła cieszyć się życiem tak, jak potrafią ludzie bez bólu!
Od lat cierpię na migreny i źle toleruję tabletki. Obie nasze córki też mają migreny. Zawsze boję się wziąć pigułkę, bo robi mi się niedobrze i mam problemy z krążeniem. Bardzo chciałbym wziąć udział w stażu.
W zeszłym roku, we wrześniu 2015 roku, leczyłem się w Kiel Pain Clinic. Mam przewlekłą migrenę!!!! Życie z nią jest bardzo trudne. Nieważne, czy chodzi o pracę, czy o życie prywatne! Zrobiłbym wszystko, żeby być w miarę zdrowym!!! Jako obiekt testowy byłbym tam od razu...
ŻYCIE BEZ BÓLU - po prostu fantastyczne.
Byłoby miło – mieć „normalną” głowę, móc spać spokojnie i po prostu cieszyć się dniem… każdego dnia!
Proszę utrzymać linię!
Cierpię na migrenę od około 26 lat i chciałbym zgłosić się na ochotnika jako obiekt testów!Życie bez migreny!!!Niewyobrażalne, genialne, cudowne...
Ja też bym tam był w mgnieniu oka! Nieznośny ból przez pół tygodnia, 52 tygodnie w roku, nikt nie może tego znieść! Nareszcie wolny!
Od dzieciństwa cierpię na migreny z nudnościami, a wymioty to zawsze koszmar i tak jest już prawie 30 lat. Od kilku lat biorę citalopram na ataki paniki. A boję się spróbować tryptanów ze względu na interakcje. Inne leki mi nie pomagają. Oznacza to, że mogę sobie z tym poradzić za każdym razem bez leków. Mam atak około 1-2 razy w miesiącu, a potem po prostu leżę w łóżku i wymiotuję. Zatem życie bez migreny byłoby marzeniem, moim największym marzeniem.
To byłoby błogosławieństwo!
Od 50 lat cierpię na migrenę, a od 10 lat na depresję.Od razu zgłosiłabym się jako osoba testująca, aby uzyskać normalną jakość życia. Ten wynalazek byłby błogosławieństwem!
Po około 28 latach migreny i po sprawdzeniu całej profilaktyki chciałbym oderwać szczepienie raz w miesiącu i zrobić bez migreny. Mam nadzieję, że wkrótce będzie to dostępna metoda.
Stwierdzono u mnie chroniczną migrenę.
Natychmiast udostępniłbym się jako obiekt testów.
Niewiarygodne, tyle komentarzy, z których prawie wszystkie mogłeś sam napisać. Mam 42 lata i migreny mam odkąd pamiętam. Utrzymuję się na beta-blokerach, a kiedy mam ataki (obecnie 2 w tygodniu), biorę Allegro. Jakość życia i chęć do życia spada z roku na rok – pomoc poprzez szczepienie brzmi zbyt pięknie, aby mogła być prawdziwa. Jeśli wypróbowałeś już wszystko, co możesz, aby wyleczyć migrenę, trudno mieć nadzieję, że znów będziesz mógł prowadzić beztroskie życie. Mieszkam na południe od Monachium i od razu zgłosiłbym się do pracy jako stażysta.
Profesorze Göbel, dobrze, że są lekarze tacy jak Pan, którzy kontynuują badania i wiedzą, co oznacza ból migrenowy - dziękuję!
Również byłam w Waszej klinice w 2010 roku i znacznie lepiej radziłam sobie z nowo przepisanymi lekami, miałam mniej migren i mniej bólu. Miał prawie dobrą jakość życia. Teraz ataki znów się nasilają, przez trzy dni i jedną noc odczuwałem straszny ból, a czopki Novalgin i Maxalt nie chciały na mnie działać. Byłoby wspaniale, gdyby szczepionka zadziałała. W międzyczasie zdiagnozowano u mnie poważną niepełnosprawność wynoszącą 50%, co być może jest ważne dla innych osób cierpiących na migrenę.
Ja również byłbym dyspozycyjny od zaraz. Skutki uboczne itp. nie miałyby znaczenia, ponieważ nie mogą być tak poważne, jak bóle głowy i migreny prawie 24 godziny na dobę, 7 dni w tygodniu
Chętnie zgłosiłbym się również na ochotnika jako obiekt testów. Cierpię na migrenę od 25 lat i próbowałem wielu aplikacji, ale bez większego powodzenia. Do tej pory pozostałam bezdzietna z obawy, że nie będę w stanie opiekować się dzieckiem i że przekażę tę straszną chorobę. Czasami choroba tak mnie trzyma, że nie czuję już, że warto żyć.
Witam, Panie Profesorze Göbel,
na migrenę cierpię od 10. roku życia, czyli od 45 lat.
Ponieważ jestem od 2 czerwca. Jeśli będę w Waszej klinice, chętnie zgłoszę się na ochotnika jako osoba testująca!
Jakie to byłoby miłe.
Codziennie odczuwam bóle głowy, a ataki migreny mam pełne co 3-5 dni.
Boję się przekazać tę chorobę swoim dzieciom, a nie mam jeszcze dzieci.
Życzę wszystkim dużo nadziei i czasu wolnego od bólu.
Bo nadzieja umiera ostatnia.
Cierpię na migreny od 30 lat, zwykle 12-19 dni w miesiącu. Jeśli ta szczepionka rzeczywiście pomoże i ją dostanę, spełni się dla mnie od dawna niespełnione marzenie i skończą się długie cierpienia.To byłby naprawdę postęp w medycynie, za którym tak długo tęskniło wiele osób cierpiących na migrenę.
Aby w końcu żyć bez bólu, od razu oddałabym się do dyspozycji
Od 15 lat cierpię na migreny, najpierw tylko podczas okresu, potem pogoda się pogorszyła i teraz mam już prawie ciągłe migreny. Spróbowałabym od razu, żeby w końcu pozbyć się tego bólu, jakość życia jest po prostu na poziomie zera.
Na migrenę cierpię od 30 lat. Zawsze brałam cafergot. Idealne dla mnie! Różne tryptany nie pomogły. Nigdy nie miałem żadnych skutków ubocznych po ergotaminie. Lekarze rodzinni nie mogą już wystawiać recept w Austrii ze względu na ergotaminę. Jestem bardzo, bardzo zdesperowana, bo cafergot jest dla mnie jedynym rozwiązaniem. Biorę teraz eumitan, który też nie pomaga. Potrzebuję 3 tabletek dla ulgi i wtedy to wraca znowu. Cafergot tylko pół czopka. Proszę kto może mi pomóc??
Mam migreny z 15 atakami miesięcznie od 35 lat. Raport dał mi nadzieję. Chciałbym wziąć udział w takim badaniu.
Na migrenę z aurą cierpię od 10 roku życia.
Miesięcznie mam do 20 napadów. Zamknięcie PFO wykonano 4 lata temu i biorę Plavix. Po zażyciu Plavixu nie mam już aury. Ale obecnie mam atak migreny 2 do 3 razy w tygodniu bez aury. Bierz Allegro. Obawiam się, że nie będę już mógł brać Plavixu. Wtedy nie byłbym już w stanie pracować (na komputerze), bo mam problemy ze wzrokiem i inne awarie (problemy z mową) aż do 20 razy dziennie. Takie szczepienie byłoby świetne.
Być normalnie odpornym. Sen. Oddałbym się jako obiekt testów.
Od 15. roku życia cierpię na migrenę i byłbym bardzo zainteresowany wzięciem udziału w tym badaniu oraz śledzeniem jego przebiegu. Mieszkam w Berlinie.
Szanowny Panie. prof. Göbel,
Miło mi czytać, jak wspieracie osoby cierpiące na migrenę.
Ja (52 lata) cierpię na migreny od 46 lat i mam do 20 ataków miesięcznie.
Moja radość z tego, że żyję, jest bardzo „pokorna”! Chyba tylko córka (15 lat) mnie podtrzymuje i mam wobec niej poczucie winy, bo przekazałam córce migrenę.
Pierwszy atak miała, gdy miała 4 lata!! Niestety Austria jest krajem rozwijającym się, jeśli chodzi o migreny.
W Szpitalu Ogólnym w Wiedniu znajduje się poradnia leczenia bólu głowy, ale nie można się umówić na wizytę (czas oczekiwania 2 lata!).
Osobiście biorę Relpax 40mg – ale nie mogę brać więcej niż 10 tabletek miesięcznie.
Ten Twój raport „Szczepienie CGRP przeciwko migrenom” jest wspaniały i daje nadzieję – może dla mnie już nie,
ale mojej córce (15 lat) może dzięki temu uda się polepszyć swoje życie.
Z głębi serca życzę wszystkiego najlepszego
i najlepsze życzenia z Wiednia
Wszyscy ludzie, którzy są przeciwni przemysłowi farmaceutycznemu (a zdarza się to bardzo często) powinni doświadczyć nadziei, gdy prawie codziennie cierpi się na migreny i wolno brać tryptany tylko przez 10 dni. Aktualnie jestem na triptanowej przerwie i przeżywam piekło na ziemi. Perspektywa pomocy, choćby za kilka lat, jest po prostu cudowna. Dziękuję wszystkim pracującym nad tym lekiem!
Drogi profesorze Göbel,
po ponad 30 latach migreny, Twój raport daje nadzieję, że wkrótce poczujesz ulgę. Uwolnij się od ataków migreny, które zdominowały moje życie – i życie milionów ludzi – o wiele za długo. Polecam Pana do Nagrody Nobla w dziedzinie medycyny. :-)) Bardzo dziękujemy za lata zaangażowania!
Do tej pory kobiety narzekały na swoje cierpienie, ale dotyka ono także mężczyzn.
Cierpię na migrenę od 39 lat.
Prowadzę działalność gospodarczą i stale pracuję, więc tylko niedzielę mam jako dzień wolny. Kiedy dostaję ataków bólu, zwykle leżę w łóżku.Mam nawet w swoim towarzystwie łóżko, z którego mogę wyciągać się w razie ataków w ciągu tygodnia. Dużo czerpię tam z życia, dlatego chciałbym zostać wolontariuszem jako obiekt testowy.
Szanowny Panie Profesorze Göbel,
byłam w Państwa klinice dopiero na przełomie stycznia i lutego 2015 r., a już czuję się znacznie lepiej.Aby w
końcu pozbyć się migreny, chętnie zgłosiłabym się jako osoba badana.
Od dzieciństwa cierpię na silne migreny i od razu zgłosiłabym się na ochotnika do tego badania…
Właśnie wróciłem do domu od rodziny i też miałem ten problem….
Próbuję wszystkiego od ponad 15 lat... Mam teraz 37 lat i od miesięcy mam ataki paniki przed kolejnym atakiem. Nie wiem, jak sobie z tym radziłam wcześniej bez mojego cudownego sumatryptanu? Jeśli „tylko” potrzebuję 4-5 w ciągu 72 godzin, jest to „dobry” atak. Zrobiłbym prawie wszystko, żeby się wyleczyć. Byłbym nawet szczęśliwy, gdybym był dostępny jako obiekt testów! Spełni się marzenie wszystkich marzeń***
Mam 41 lat i od dziecka cierpię na migrenę. Niestety, pięć lat temu pojawiły się także ataki paniki, a obecnie depresja. Ponieważ również cierpię na astmę, nie mogę jej zapobiegać za pomocą beta-blokerów. Od razu zaproponowałbym siebie jako królika doświadczalnego.
To byłoby rewolucyjne! Migreny od 65 lat – od razu wziąłby udział w badaniu.
Witam, chętnie wezmę udział w badaniu od zaraz. Cierpię na migreny od 53 lat i obecnie są one szczególnie częste. LG Charlotte Maslonka
Jeśli to zadziała na dłuższą metę, byłoby to błogosławieństwem dla wszystkich cierpiących na migrenę...
Próbowałem już wielu rzeczy, od medycyny konwencjonalnej po medycynę alternatywną,
ale bez powodzenia... tylko mój portfel stał się dużo lżejszy .
Wziąłbym udział w badaniu natychmiast…. Od 13 lat cierpię na migreny niemal codziennie.
To byłoby świetnie! Błogosławieństwo dla osób dotkniętych, których jakość życia cierpi !!
Po 45 latach migreny z obecnie od 13 do 16 dni migreny w miesiącu chciałbym z niej skorzystać!
Życie bez bólu migreny? To jest poza moją wyobraźnią ... niebo na ziemi !!!
To byłaby naprawdę rewolucja. Chciałbym wziąć udział w tym badaniu. Cierpię już od ponad 35 lat!
To byłoby naprawdę spełnienie marzeń - po 60 latach stosowania wszelkiego rodzaju leków...
Proszę o więcej informacji na temat tej metody - dziękuję
Szanowny Profesorze Göbel,
Byłoby miło.
Cierpisz na chroniczne migreny. Od razu oddałbym się do dyspozycji jako osoba testująca. Naprawdę mam nadzieję dla wszystkich cierpiących na migrenę, że to lekarstwo odniesie sukces, którego wszyscy pragniemy!
zbyt piękne, aby mogło być prawdziwe….ustawiłbym się natychmiast…
„Po 54 latach migreny to była główna nagroda!
Profesorze Göbel,
czytanie tego było cudowne. Miejmy nadzieję, że nie będzie zbyt wielu przeszkód biurokratycznych do pokonania, aby leczenie zastrzykami mogło zostać rozpoczęte tak szybko, jak to możliwe. Jako były pacjent Waszej kliniki chciałbym zgłosić się jako osoba badana.Nawet po zastosowaniu botoksu nie odczuwam prawie żadnej ulgi.
Od razu oddałbym się do eksperymentów. Po 42 latach migreny zaczynam być bardzo zmęczony
Od razu bym się udostępnił. Marzeniem byłoby dla mnie znów być wolnym od bólu.
Dołączyłbym natychmiast!!! Marzenie... by w końcu żyć bez bólu!
43 lata piekła w mojej głowie, a co za tym idzie w moim życiu.Bardzo chciałabym wziąć udział w badaniu.
Wreszcie bez bólu. To byłby wspaniały prezent. Wypróbowałbym go natychmiast!
To zasługiwałoby na Nagrodę Nobla!
Och,
to byłby sen,
koniec z migreną :-)
Byłoby wspaniale! Spróbowałbym natychmiast!
Gdyby to naprawdę się powiodło i ktoś stał się lub pozostał wolny od bólu, byłoby to przełomowe. Myślę, że każda osoba cierpiąca na migrenę, łącznie ze mną, natychmiast zgłosiłaby się na ochotnika do wzięcia udziału w badaniu.
Rewolucja w leczeniu bólu migrenowego. Od razu bym się udostępnił.
To byłby cud po 37 latach migreny!!!
to byłoby cudowne
marzenie by się spełniło