La migraña es una de las enfermedades más debilitantes conocidas por la humanidad. Según un informe reciente de la OMS, ocupa el sexto lugar entre las enfermedades más discapacitantes. Si se incluye la cefalea por abuso de medicamentos, ocupa el tercer lugar. Considerando las diversas formas de los 367 tipos de cefalea conocidos actualmente, la migraña y las cefaleas son, con diferencia, las enfermedades más graves, frecuentes y debilitantes en los seres humanos.
Las opciones actuales de tratamiento farmacológico para la migraña incluyen terapias preventivas y el tratamiento de las crisis de cefalea agudas. Un porcentaje significativo de pacientes no experimenta un alivio suficiente mediante terapias preventivas. Incluso las terapias actuales para las crisis, con sus opciones existentes, podrían no proporcionar un alivio efectivo, y podrían existir contraindicaciones o intolerancias.
Estudios recientes han aportado amplia evidencia de que el péptido relacionado con el gen de la calcitonina, o CGRP, desempeña un papel importante en el desarrollo, el mantenimiento y la cronicidad de las migrañas. El CGRP es un neuropéptido compuesto por 37 aminoácidos. Está codificado por el mismo gen que la hormona calcitonina.
Por lo tanto, el CGRP se ha convertido en el foco de nuevas opciones de tratamiento para la migraña. El desarrollo de antagonistas del receptor CGRP, los llamados gepantes, representa una nueva clase de fármacos para el tratamiento agudo de las crisis de migraña. Sin embargo, su desarrollo se detuvo debido a la toxicidad hepática.
La investigación actual se centra intensamente en el desarrollo de anticuerpos monoclonales contra el CGRP. Tanto los mecanismos vasculares como neuronales desempeñan un papel en la compleja fisiopatología de la migraña. Los neurotransmisores clave involucrados en el desarrollo del dolor migrañoso incluyen la serotonina (5-hidroxitriptamina, 5-HT), el óxido nítrico y el CGRP. El CGRP consta de 37 aminoácidos y fue descubierto hace aproximadamente 30 años. Está ampliamente distribuido por todo el sistema nervioso periférico y central. Cada órgano principal está inervado por fibras nerviosas que contienen CGRP. En particular, el CGRP y sus receptores se encuentran en estructuras anatómicas que son significativas para el desarrollo de la migraña. Estas incluyen la corteza cerebral, las meninges, el hipotálamo, el cerebelo y el tronco encefálico. El CGRP también se encuentra en muchas neuronas que son importantes para el sistema de procesamiento del dolor trigémino-vascular. El CGRP se encuentra en más del 50% de las neuronas del nervio trigémino. También participa en el procesamiento del dolor en el tronco encefálico, lo que aumenta la sensibilidad a los estímulos. En la periferia, el CGRP es liberado por las neuronas que inervan los vasos sanguíneos, en particular los cardíacos y los intracraneales. El CGRP provoca una vasodilatación pronunciada y sostenida, mediada por la activación de los receptores del músculo liso. Estos procesos son cruciales en la inflamación neurogénica, ya que provocan vasodilatación, sensibilización, hinchazón y otros mecanismos inflamatorios.
Los hallazgos iniciales han demostrado que, al inicio de una crisis migrañosa, el CGRP provoca la dilatación de la arteria cerebral media y la arteria meníngea media. Estudios posteriores han demostrado que el CGRP desencadena y mantiene la sensibilización periférica y central. La sensibilización se considera un paso fundamental en el desarrollo de una crisis migrañosa y la cronicidad de la enfermedad. La inflamación neurogénica durante una crisis migrañosa se modula por la liberación de CGRP, directamente debido a la vasodilatación e indirectamente debido a la liberación de sustancia P, lo que resulta en extravasación plasmática. Además, el CGRP induce la degranulación de los mastocitos y desencadena la liberación de sustancias proinflamatorias e inflamatorias. La liberación de citoquininas conduce a la sensibilización de las neuronas sensoriales. Como neuromodulador, el CGRP activa la transmisión sináptica de glutamato en el asta dorsal y el núcleo trigémino. Esto conduce a un aumento adicional de la sensibilización central y la activación de los reflejos nociceptivos. La conducta relacionada con el dolor también se activa mediante la activación de neuronas centrales, en particular en la amígdala. La ansiedad y la conducta de evitación también se ven afectadas. El inicio de una crisis migrañosa se asocia con la depresión cortical propagada (DCP). Esta implica una reducción local o la interrupción completa de la actividad neuronal en la corteza cerebral. Esta despolarización se propaga lenta y gradualmente por la corteza, de forma análoga a la propagación del aura migrañosa. La DCP provoca la liberación de CGRP, lo que provoca inflamación neurogénica que incluye sensibilización, hiperemia, vasodilatación, hinchazón y deterioro funcional.
Los estudios también demuestran que el CGRP interviene en el desarrollo de hipersensibilidad a estímulos sensoriales, en particular la fotofobia. Dado que el CGRP también puede liberarse ampliamente en el sistema nervioso entérico, se cree que síntomas gastrointestinales como la estasis gástrica, las náuseas y los vómitos están modulados por mecanismos del CGRP.
La conexión entre el desarrollo de la migraña y el CGRP surgió inicialmente del descubrimiento de que la estimulación del ganglio trigémino provoca la liberación de CGRP. Durante una crisis migrañosa espontánea, se encuentran concentraciones elevadas de CGRP en la vena yugular. La saliva también muestra concentraciones elevadas de CGRP durante una crisis migrañosa aguda. Estos niveles pueden reducirse mediante el tratamiento con un triptán. Incluso entre crisis migrañosas, los pacientes con migraña presentan niveles elevados de CGRP.
La administración intravenosa de CGRP puede desencadenar directamente ataques de migraña en pacientes con migraña. Los pacientes que no padecen migraña experimentan cefaleas sin los síntomas típicos de la migraña tras la administración de CGRP. Por lo tanto, se asume que los pacientes con migraña tienen una sensibilidad particular al CGRP. Finalmente, el bloqueo selectivo del receptor de CGRP puede detener eficazmente un ataque agudo de migraña.
antagonistas del receptor CGRP
Con base en estos hallazgos, en los últimos años se han aplicado sistemáticamente diversos enfoques para utilizar terapéuticamente los nuevos conocimientos sobre el CGRP en la fisiopatología de la migraña. Inicialmente, se desarrollaron los llamados gepantes, antagonistas del receptor del CGRP, como una clase completamente nueva de medicamentos para la migraña. Su mecanismo de acción se basaba en la inhibición competitiva del CGRP endógeno en el receptor del CGRP. Actualmente, se han desarrollado y probado seis gepantes diferentes en ensayos clínicos. Los resultados mostraron una eficacia clínica que superó significativamente la de los placebos, pero fue comparable a la de los triptanes. Una ventaja clave de los gepantes es que, a diferencia de los triptanes, no causan vasoconstricción. El desarrollo de antagonistas del CGRP se interrumpió debido a la toxicidad hepática durante el uso a largo plazo y porque su eficacia no fue superior a la de los triptanes. Sin embargo, su mecanismo de acción demostró el importante papel del CGRP en la fisiopatología de la migraña y la posibilidad de utilizarlo en su tratamiento.
Anticuerpos monoclonales contra CGRP
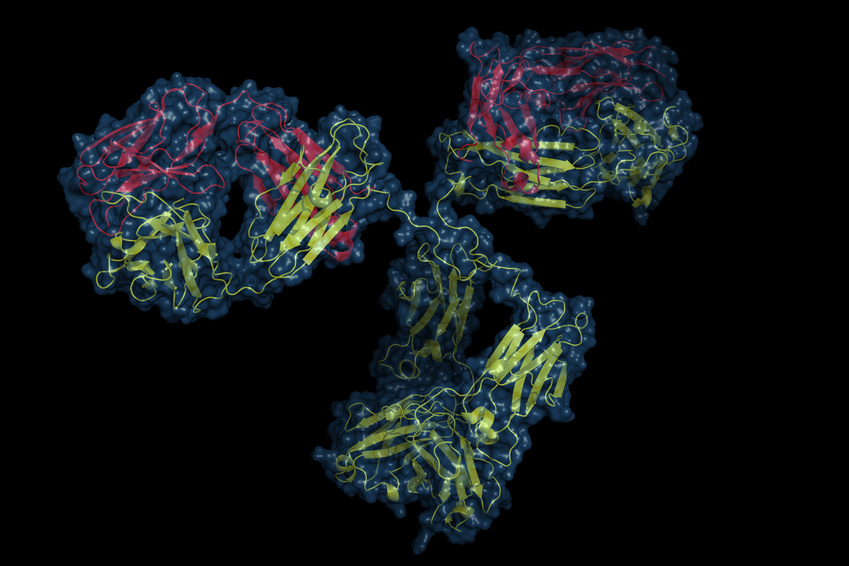
Los efectos biológicos del CGRP pueden bloquearse alternativamente mediante anticuerpos monoclonales dirigidos contra el propio CGRP o contra su receptor. Actualmente, cuatro anticuerpos monoclonales para el tratamiento preventivo de la migraña episódica o crónica se encuentran en programas de desarrollo clínico. Tres anticuerpos monoclonales se dirigen al propio neuropéptido: ALD-403 (Alder Biopharmaceuticals), LY2951742 (desarrollado por Arteau's Therapeutics y posteriormente por Eli Lilly) y LBR-101, actualmente conocido como TEV-48125 (desarrollado por Labrys Biologics-Pfizer, adquirida por Teva Pharmaceuticals). Un cuarto anticuerpo monoclonal se dirige al propio receptor del CGRP: AMG334 (Amgen, Inc.; posteriormente por Novartis).
ALD403 se administra mediante infusión cada tres meses. Se esperan los resultados de un ensayo de fase 2b para la prevención de la migraña crónica en julio de 2016. Un ensayo de fase 3 investiga la prevención de la migraña episódica frecuente. Está previsto que este ensayo concluya en abril de 2017. Se prevé que otro ensayo de fase 3 comience en 2016. Además, un ensayo de fase 2b analizará la autoadministración de ALD403 en pacientes con migraña episódica.
El TEV-48125 se está investigando actualmente en un ensayo de fase 3. Se espera que el análisis de su eficacia en la migraña crónica concluya en octubre de 2017.
El LY2951742 se investigó en un estudio de fase 2 finalizado en agosto de 2015. El estudio analizó el efecto preventivo de la administración subcutánea del fármaco cada cuatro semanas durante 12 semanas en la migraña episódica. Se demostró una eficacia significativa en comparación con placebo para reducir el número de días de migraña. Actualmente se están realizando más estudios de fase 3. Se prevé que un estudio que investiga la eficacia en la migraña episódica concluya en diciembre de 2017. Otro estudio que investiga la eficacia en la migraña crónica concluya en abril de 2018. Se prevé que un estudio adicional, abierto y a largo plazo, concluya en septiembre de 2017.
El AMG334 se está investigando actualmente en un ensayo de fase 2 para evaluar su eficacia preventiva en la migraña crónica. La eficacia y la seguridad a largo plazo se analizarán en otro ensayo de fase 2, cuya finalización está prevista para julio de 2017. Se prevé que dos ensayos de fase 3 que investigan su eficacia preventiva en la migraña episódica concluyan en octubre de 2017 y febrero de 2018, respectivamente.
Compatibilidad y seguridad
Dada la experiencia adquirida con el desarrollo de antagonistas del CGRP, los resultados sobre la tolerabilidad y seguridad de los anticuerpos monoclonales contra el CGRP deben esperarse en estudios a largo plazo. Estos anticuerpos no bloquean selectivamente la vasodilatación mediada por el CGRP en todo el organismo. Sus efectos sobre la inhibición de la vasodilatación cardiovascular, por ejemplo, durante el estrés o la isquemia, así como sus interacciones en el tratamiento de la hipertensión arterial, siguen siendo inciertos. Se pueden concebir interacciones con el flujo sanguíneo cardíaco y cerebral. Sin embargo, estudios previos no han mostrado efectos sobre el ECG ni otros parámetros hemodinámicos. La posible inducción de reacciones inmunológicas en pacientes tras la administración de estos anticuerpos monoclonales también sigue siendo una incógnita.
eficacia
Sin duda, las opciones actuales de tratamiento preventivo para la migraña son insatisfactorias para muchos pacientes. Los anticuerpos monoclonales también han demostrado ser ineficaces en algunos pacientes estudiados en ensayos clínicos previos. Por ejemplo, el 47 % de los pacientes con una dosis baja y el 45 % con una dosis alta de TEV-41825 no lograron una reducción del 50 % en la frecuencia de la migraña en términos de días de cefalea. Es cierto que la migraña es una enfermedad compleja mediada por una amplia variedad de vías fisiopatológicas y diversas moléculas. El papel del CGRP varía de un paciente a otro. Sin embargo, parece haber un subgrupo de pacientes que responden muy eficazmente al tratamiento con anticuerpos monoclonales contra el CGRP. Más del 15 % de los pacientes tratados informaron un cese completo de las crisis de migraña. Por lo tanto, este tratamiento ofrecerá opciones muy eficaces para algunos pacientes, mientras que otros no se beneficiarán lo suficiente. Además, aún queda por ver la eficacia comparativa con los medicamentos preventivos existentes. Sin embargo, algo ya está claro: la prevención de la migraña debe abarcar diversas estrategias. En todos los casos, especialmente en los graves y crónicos, es necesaria una terapia individualizada y diferenciada. Incluso con anticuerpos monoclonales, no se espera un tratamiento que elimine las migrañas con una sola inyección y permita vivir como uno desea.










Llevo 30 años sufriendo migrañas. A veces, tenía dos ataques, tres días a la semana. Con solo siete días a la semana, no me queda mucho tiempo útil.
También estoy de acuerdo con los comentarios sobre ofrecerme como voluntario para un estudio de inmediato.
Debido a la cantidad de medicamentos que tomo, ya he tenido que pasar varios meses de abstinencia debido a las cefaleas inducidas por ellos.
Espero mejorar para no perder mi trabajo.
Estoy de acuerdo con la Sra. Gilles. Tengo casi 50 años y he sufrido migrañas desde la adolescencia. Mi esperanza de que la menopausia me trajera una mejoría no se ha materializado. Si necesitan participantes para un estudio, ¡me apunto!
Yo también he sufrido migrañas severas y cefaleas tensionales durante 28 años. Actualmente, estoy experimentando otro período de dolor intenso, hasta el punto de no poder trabajar. Tengo 57 años y casi he perdido toda esperanza de liberarme del dolor. Me encantaría poder probar esta inyección de anticuerpos.
Llevo 45 años sufriendo migrañas y me he vuelto incapaz de trabajar debido a ellas. Actualmente, las tengo de 10 a 15 días al mes. Gracias a Ascotop, ahora puedo controlarlas en cierta medida.
Me ofrecería de inmediato como voluntario para participar en estudios.
Sigo esperando una vacuna y me preocupa cómo evolucionará la medicación a medida que envejezca (tengo casi 60 años).
Sería maravilloso si pudiera vivir para ver esta revolución.