Der Migräneschmerz basiert nach heutigen Erkenntnissen auf einer neurogenen Entzündungsreaktion an den Arterien der Hirnhäute. Entzündungsstoffe werden dort im Initialstadium der Migräneattacke freigesetzt. Diese führen zu einer verstärkten Schmerzempfindlichkeit der Hirnhäute mit Schwellung und Erweiterung der Gefäßwände. Jeder Pulsschlag führt zu einem pochenden, hämmernden Migräneschmerz, jede Bewegung des Kopfes schmerzt aufgrund Allodynie und Hyperpathie und verstärkt die Beschwerden. Migränepatienten versuchen daher im Anfall möglichst Ruhe und Reizabschirmung einzuhalten sowie körperliche Tätigkeit und Erschütterungen zu vermeiden.
In den letzten Jahren ist es gelungen, spezifische Antikörper gegen Botenstoffe zu entwickeln, welche die Entzündung während des Migräneanfalles bedingen. Im Mittelpunkt steht dabei das Calcitonin Gene-Related Peptide, kurz CGRP. Es ist ein Neuropeptid, das aus 37 Aminosäuren besteht und durch das identische Gen wie das Hormon Calcitonin kodiert wird. CGRP zählt zu den stärksten gefäßerweiternden Substanzen und spielt eine wichtige Rolle in der Entstehung der Migräne. Gibt man sogenannte monoklonale Antikörper, kann die Wirkung dieser Entzündungsstoffe für einige Wochen gestoppt und die Wahrscheinlichkeit für Migräneattacken reduziert werden. Es wurden vier Antikörper entwickelt und in zahlreichen Studien getestet: Erenumab (AMG 334), Galcanezumab (LY2951742), Fremanezumab (TEV-48125) und Eptinezumab (ALD403).
- Als erster Vertreter dieser neuen Wirkstoffklasse wurde Erenumab (Aimovig®) im Juli 2018 in Deutschland zugelassen und ist seit November 2018 in den Apotheken erhältlich. Ein Rechtsstreit belastet die Kooperation von Novartis mit dem US-Biotech-Unternehmen Amgen, welches Erenumab entwickelt hat. Die Firmen beschuldigten sich am 4. April 2019 vor Gericht gegenseitig, ein Kooperationsabkommen zu Aimovig verletzt zu haben. Amgen hat mit dieser Begründung die Migräne-Kooperationsvereinbarung zu Erenumab aufgekündigt. Amgen beschuldigt Novartis, gegen diese Vereinbarung verstossen zu haben, da Novartis angeblich mit einem Konkurrenten an einem ähnlichen Mittel wie Aimovig arbeite. Novartis bestreitet dies.
- Der zweite Antikörper Galcanezumab (Emgality®) zur Migräneprophylaxe wurde zum 1. April 2019 auch in Deutschland in den Apotheken verfügbar. In der EU ist Galcanezumab bereits seit November 2018 zugelassen.
- Der dritte Antikörper, Fremanezumab (Ajovy®) wurde am 31. Januar 2019 ebenfalls vom Humanarzneimittelausschuss der EMA zur Zulassung empfohlen und im April 2019 von der Europäische Kommission zugelassen. Ajovy unterscheidet sich u.a. von Aimovig und Emgality durch das Anwendungsintervall: Es steht zusätzlich zur monatlichen eine vierteljährliche Applikation zur Verfügung.
Die jetzt verfügbaren Antikörper haben in sehr groß angelegten internationalen Studien alle ihre Wirksamkeit belegt. Es gibt Antikörper, die gegen den Liganden CGRP wirken (Galcanezumab, Fremanezumab, Eptinezumab) oder aber den Rezeptor für CGRP blockieren (Erenumab). CGRP wird eine wichtige Rolle in der Entstehung der Migräne zugeschrieben. In Migräneattacken finden sich erhöhte CGRP-Spiegel, bei der chronischen Migräne auch zwischen den Anfällen. Durch die intravenöse Gabe von CGRP können bei Migränepatienten migräneartige Kopfschmerzen hervorgerufen werden. Die in der Migräneakuttherapie wirksamen Triptane hemmen die Freisetzung von CGRP. Schließlich konnte mit den sog. Gepanten gezeigt werden, dass durch die Hemmung des CGRP-Rezeptors sowohl akut Migräneattacken unterbrochen werden können als auch bei regelmäßiger Einnahme diesen vorgebeugt werden kann.
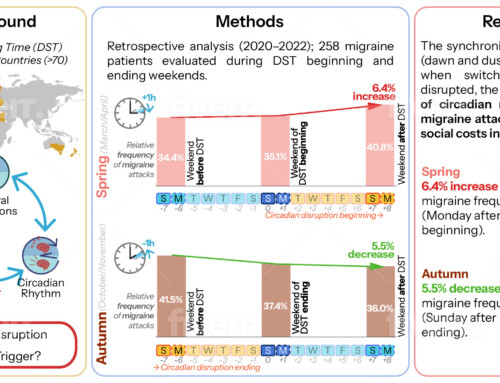
Fremanezumab wurde an insgesamt 2.000 Patienten in Zulassungsstudien untersucht. In der Phase-III-Studie Halo EM wurden Patienten mit episodischer Migräne und in der Phase-III-Studie Halo CM wurden Patienten mit chronischer Migräne untersucht. Die Studie Halo CM verglich an 1.130 Patienten die Wirksamkeit von 225 mg Fremanezumab in monatlicher Dosierung sowie 675 mg Fremanezumab in vierteljährlicher Dosierung im Vergleich zu einer Placebo-Anwendung. Im Durchschnitt litten die Patienten an 13,2 Tagen pro Monat an Migräne (Gruppe mit monatlicher Fremanezumab-Anwendung) bzw. an 12,8 Tagen pro Monat (vierteljährliche Fremanezumab-Gabe) bzw. 13,3 Migränetagen pro Monat (Placebogruppe). In der Gruppe der Patienten mit vierteljährlicher Fremanezumab-Gabe wurden eingangs 675 mg Fremanezumab subkutan gegeben. Nach einem Zeitraum von 4 und 8 Wochen wurden Placebogaben eingesetzt. Patienten, die monatlich Fremanezumab erhielten, wurden mit einer Startdosis von 675 mg Fremanezumab behandelt. Anschließend erhielten sie jeweils 225 mg Fremanezumab in der Woche 4 und der Woche 8. Als Hauptzielparameter war die Reduktion der durchschnittlichen Kopfschmerztage pro Monat herangezogen worden. Ein Kopfschmerztag war durch mindestens 4 Stunden Beschwerden pro Tag oder die Anwendung von migränespezifischen Akutmedikamenten am Tag definiert.
- Die deutlichste Reduktion konnte in der Gruppe mit monatlicher Gabe beobachtet werden. In dieser Gruppe wiesen die Patienten im Durchschnitt 4,6 Tage weniger Migräne pro Monat auf. 41% der Patienten erzielten bei dieser Applikationsweise eine Halbierung der Kopfschmerztage pro Monat.
- Wurde Fremanezumab im Abstand von 3 Monaten verabreicht, konnte eine Verbesserung der monatlichen Migränetage um 4,3 Tage beobachtet werden. In dieser Gruppe erreichten 38% der Patienten eine Reduktion der Kopfschmerztage um 50%.
- Im Vergleich dazu konnte in der Placebogruppe eine Reduktion der Kopfschmerztage pro Monat um 2,5 Tage aufgedeckt werden. 18% in der Placebogruppe zeigten eine Halbierung der Kopfschmerztage pro Monat.
Der Zulassungstext sieht die Anwendung von Fremanezumab (wie auch bei Erenumab und Galcanezumab) bei erwachsenen Patienten vor, die an mindestens 4 Tagen pro Monat an Migräne leiden. Die Antikörper sind sowohl für die vorbeugende Behandlung von episodischer und chronischer Migräne zugelassen. Fremanezumab ist der bisher einzige verfügbare Antikörper, bei dem auch bei vierteljährlicher Anwendung mit 675 mg in der dreifachen Monatsdosis von jeweils 225 mg eine signifikante Wirksamkeit nachgewiesen ist. Aktuell ist noch keine spezielle Dreimonatsspritze verfügbar, mit der Patienten mit nur einer einzigen Anwendung die entsprechende Dosis von 675 mg einsetzen können. Daher müssen aktuell Patienten auch bei dreimonatiger Anwendung 3 Injektionen, wenn auch zu einem einzigen Zeitpunkt, einsetzen.
Als häufigste unerwünschte Nebenwirkung traten Schmerzen an der Injektionsstelle auf. Diese unterschieden sich nicht bedeutsam zwischen der Gruppe, die mit Fremanezumab oder Placebo behandelt wurde.
Bei der Anwendung von monoklonalen Antikörpern zur Vorbeugung der Migräne müssen einige Besonderheiten erwogen werden:
- Monoklonale Antikörper sind sehr teure Medikamente. Aktuell gibt es noch keine Vergleichsstudien zu den bisherigen leitliniengerechten vorbeugenden Migränemedikamenten. Vergleicht man die Wirksamkeitsdaten zu den bisherigen Wirkstoffen, zeigen die Mittelwerte keine besondere Überlegenheit bezüglich der Wirksamkeit. Der besondere Zusatznutzen liegt in der Tatsache, dass Patienten, die auf die bisherigen verfügbaren Arzneimittel nicht ansprachen, bei denen Gegenanzeigen bestanden oder diese nicht vertragen haben, eine Wirksamkeit mit den monoklonalen Antikörpern dennoch erreicht werden kann. Aus Gründen der Wirtschaftlichkeit werden daher die neuen Behandlungsoptionen bei den Patienten einzusetzen sein, für die die bisherigen leitliniengerechten Migräneprophylaktika nicht hilfreich waren.
- Die monoklonalen Antikörper müssen mit einem Autoinjektor als Injektion unter die Haut verabreicht werden.
- Die monoklonalen Antikörper haben eine sehr lange Wirkdauer mit einer Halbwertzeit von ca. vier Wochen. Dies bedeutet, dass nach einem Monat noch ca. 50% des Wirkstoffes im Blutkreislauf zirkuliert und aktiv ist. Da es sich um eine sehr neue Medikamentenklasse handelt, können zudem Langzeiteffekte bei längerer Anwendung bisher noch nicht sicher eingeschätzt werden.
- Die Immuntherapie zur vorbeugenden Behandlung der Migräne ist keine „finale Heilung“ der Migräne. Nur etwa 30% der Patienten, die bisher nicht ausreichend auf frühere vorbeugende Behandlungsmaßnahmen angesprochen haben, können eine Reduktion der Migräneattacken um 50% oder mehr erwarten. Bei 70% der behandelten Patienten wird dieser Effekt nicht wahrscheinlich sein. Bei einem Großteil der Patienten, die diese Effektivität erreichen, werden dennoch weiterhin Migräneattacken auftreten, die mit Akutmedikamenten behandelt werden müssen.
- Migräne ist eine komplexe Erkrankung. Sie erfordert eine Anpassung der Lebensweise an die besondere genetisch bedingte Bereitschaft, mit Migräneattacken zu reagieren. Wissen, Information, Anpassen des Verhaltens durch Regulation des Tagesablaufes, Pausen, Entspannung, Sport, Ernährung und Stressabbau sind wesentliche vorrangige Voraussetzungen, um den Migräneverlauf zu kontrollieren.
Die Migräne ist nach Karies und Kopfschmerz vom Spannungstyp die dritthäufigste Erkrankung des Menschen. Bis zum 50. Lebensjahr ist sie die am schwersten behindernde Erkrankung. Sie betrifft insbesondere die produktive Lebenszeit in der Schule, im Studium, in der Ausbildung, im Beruf, bei der Familiengründung und bei sozialen Aktivitäten. Für die wissenschaftliche Gemeinschaft stellte die Migräne traditionell ein Stiefkind dar. In der Menschheitsgeschichte gab es nur geringe Fortschritte im Verständnis und in der Behandlung der Migräne. Dies ändert sich nunmehr in unserer Generation erstmals bedeutsam. Weitere wissenschaftliche Studien mit spezifischen Einsichten in die Entstehung und Behandlung der Migräne sowie öffentliche Aufmerksamkeit und Forschungsanstrengungen sind erforderlich. Grundlagen für eine verbesserte Versorgung sind spezialisierte Versorgungszentren, die schwerbetroffenen Patienten fachübergreifend multimodal und zeitgemäß behandeln können.







Also , mir hilft Ajovy sehr gut , anders als Aimovig , was bei mir nicht angeschlagen hat . Allerdings bringt dieses Medikament die Verdauung in Unordnung. Das muss man klar dazu sagen .
Ich erlitt eine schwere Hirnblutung, die Folgen waren furchtbare migränranfälle, an 5 Tagen die Woche! Nehme jetzt seit ca. Einem halben Jahr ahoi und bin ein neuer Mensch, ich habe wieder komplett Schmerz freie Tage und ein Attacke nur mehr 1-2 mal im Monat! Wahnsinn, bin sooo dankbar dass es das Medikament gibt und es bei mir sehr gut hilft!
Ich bin 59 Jahre alt und leide seit meiner Jugend an schlimmer Migräne. Ich hatte alles versucht, 2x Aufenthalt in Migräne/Schmerzkliniken, hatte ca. 8 Schmerztage pro Monat, Behandlung mit diversen Triptanen. Meine Ärztin verschrieb mir Ajovy vor 10 Monaten. Für mich ist es ein komplett neues Leben seit diesem Tag. In diesen 10 Monaten hatte ich vielleicht 5 leichte Schmerztage, absolut kein Vergleich zu früher. Auch hatte ich für einen längeren Auslandsaufenthalt die 3 Monats-Variante genommen, auch das hat perfekt funktioniert und ich hatte keinen einzigen Schmerztag, selbst bei den langen Flügen nicht, was früher ein Fiasko war. Also für mich ist diese Spritze tatsächlich das reinste Wundermittel. Schade zu hören, dass es nicht bei jedem so ist.
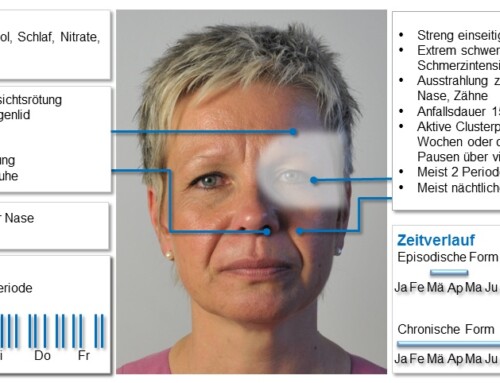
Ich bin chronischer Clusterkopfschmerz-Patient.
Seit den letzten 2,5 Jahren habe ich täglich mehrere Schmerzattackten rund um die Uhr.
Um genauer zu werden, ich wollte Sterben!
Seit 4 Monaten erhalte ich Ajovi Antikörper-Spritze.
Seit 3 Monaten habe ich keine Kopfschmerzen mehr.
Vorher nahm ich täglich bis zu 3x Triptane nasal und hatte somit sehr stark erhöhte Gefahr eines Schlaganfalls.
Ajovi hat mir mein Leben zurückgegeben :-)
Ich habe für ein halbes Jahr Aimovig genommen. Auf Grund von Problemen mit der Verdauung sind wir nun auf Ajovy gewechselt. Beide Mittel schlugen bei mir ab der ersten Einnahme super an! Ich bin auf ca. 0 bis 1 Migräne-Tag pro Monat runter und auch meine Spannungskopfschmerzen sind fast weg. Sollte ich mal leichte Kopfschmerzen haben hilft auch mal „nur“ ein Aspirin. Das war vorher nie der Fall. Die Tage nach der Einnahme von Ajovy ist es sogar so, dass ich enorme Energie habe. Ich kann seitdem auch wieder regelmäßig Sport machen.
Danke für diese Mittel – ich habe wieder ein ganz normales, entspanntes Leben!!
Ich bekomme Ajovy seit 2 Monaten und hatte seitdem keinen Migräne Anfall, vorher ca.8-10/Monat. Einzig an den ersten beiden Tagen nach Injektion Müdigkeit. Endlich ohne Schmerzen, ich hoffe es bleibt so, die Lebensqualität ist wieder da!
Ich nehme das Medikament seit drei Monaten und bin ein neuer Mensch. Ich leide auch seit meiner frühsten Kindheit unter chronischer Migräne. Es gibt keinen Therapie die ich nicht ausprobiert hätte. Bei mir schlägt Ajovy super an. Auch ich konnte damit meine Schmerztage von 15 auf 3 reduzieren und das ab der ersten Spritze. Ich bin so dankbar und glücklich und wünsche mir dass es noch vielen anderen Patienten hilft!
Super Artikel und stimmt auch mit meinen persönlichen Erfahrungen mit Fremanezumab überein!
Dieser Artikel ist der erste, den ich zum Thema lese, der das Medikament nicht als Wundermittel behandelt. Es ist keins, womit ich nicht sagen möchte, daß es kein wirksames Medikament ist. Ich bin 48 Jahre alt, habe seit meinem 5. Lebensjahr Migräne und seit ca fünfzehn Jahren 30 Schmerztage/Monat mit durchschnittlich 22 Migräneanfällen/Monat. Ich habe von Betablockern über Akupunktur bis Botox etc. alles hinter mir, erfolglos.Schlussendlich blieb mir die Erwerbsminderungsrente. Seit drei Monaten bekomme ich Ajovy und es ist leider keinerlei Wirkung eingetreten. Ich hoffe, daß sich die Euphorie für dieses Medikament dennoch bestätigt und es möglichst vielen Patienten hilft.
Allerdings sehe ich es schon kritisch, daß die Folgen des Medikaments langfristig noch überhaupt nicht überschaubar sind.