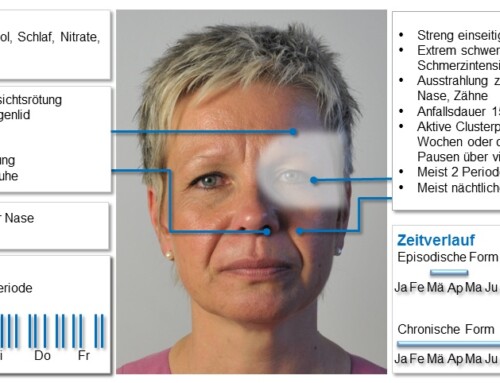
Der Gemeinsame Bundesausschuss (G-BA) hat am 2. Mai 2019 die Nutzenbewertung von Erenumab nach § 35a SGB V beschlossen. Ein beträchtlicher Zusatznutzen wurde nur für erwachsene Patienten aus den vorgelegten Daten abgeleitet, die auf keine der genannten medikamentösen Therapien/Wirkstoffklassen (Metoprolol, Propranolol, Flunarizin, Topiramat, Amitriptylin, Valproinsäure[1], Clostridium botulinum Toxin Typ A[2]) ansprechen, für diese nicht geeignet sind oder diese nicht vertragen. Als zweckmäßige Vergleichstherapie wurde die „Best Supportive Care (BSC)“ herangezogen. Als Best Supportive Care wird die Therapie definiert, die eine bestmögliche, patientenindividuell optimierte, unterstützende Behandlung zur Linderung von Schmerzen und zur Verbesserung der Lebensqualität gewährleistet. Daraus kann abgeleitet werden, dass nicht allein die medikamentöse Vortherapie für den Zusatznutzen relevant ist, sondern auch die Best Supportive Care individuell berücksichtigt werden muss. Die individuell auf den Einzelfall bezogene Best Supportive Care schließt u.a. Information, Verlaufs- und Erfolgskontrolle durch Dokumentation des Schmerzverlaufs, verhaltensmedizinische Therapieverfahren wie Entspannungstrainings, Biofeedbacktherapie, kognitive Verhaltenstherapie bzw. Stressmanagement, Behandlung der Komorbidität, interventionelle und neuromodulierende Verfahren, sowie multimodale Schmerztherapie entsprechend den Eingangskriterien und Strukturvorgaben des OPS-Codes 8-918 ein. Im Rahmen der BSC muss auch die Attackentherapie und ein ggf. bestehender Medikamentenübergebrauchskopfschmerz (MÜK) und dessen sachgerechte Behandlung berücksichtigt werden. Erenumab ist nicht für die Behandlung des MÜK zugelassen. Die Einleitung und Überwachung der Behandlung mit Erenumab sollen nach G-BA durch Ärzte erfolgen, die in der Diagnose und Therapie von Patienten mit Migräne erfahrenen sind.
[1] Entsprechend Anlage VI zum Abschnitt K der Arzneimittel-Richtlinie: wenn eine Behandlung mit allen anderen dafür zugelassenen Arzneimitteln nicht erfolgreich war oder kontraindiziert ist.
[2] Entsprechend der Zulassung nur für die chronische Migräne
Nutzenbewertung von Erenumab nach § 35a SGB V – G-BA Beschuss vom 2. Mai 2019







Hinterlasse einen Kommentar