30.7.2018. Die Migräne-Immuntherapie mit dem Wirkstoff Erenumab (Aimovig) kann nun auch in der EU vertrieben werden. Im Mai 2018 erfolgte zunächst die US-Zulassung, gefolgt von der Zulassung in der Schweiz im Juli. Nun hat die EU-Kommission Erenumab am 30.7.2018 auch für die EU den Marktzugang genehmigt. Mit Datum vom 31. Mai 2018 hat der Ausschuss für Humanarzneimittel der Europäischen Arzneimittelagentur EMA eine Empfehlung für die Zulassung von Erenumab (Aimovig) zur Prophylaxe von Migräneattacken gegeben. Das Medikament wurde bereits mit Datum vom 17. Mai 2018 von der amerikanischen Arzneimittelbehörde FDA zur vorbeugenden Behandlung von Migräne bei Erwachsenen in den USA zugelassen (Einzelheiten siehe dieser Beitrag). Aimovig ist in Form einer Lösung zur subkutanen Injektion mit 70 mg verfügbar. Der aktive Wirkstoff von Aimovig ist Erenumab. Die Wirkung erfolgt über eine Bindung an den Calcitonin Gene-Related Peptide (CGRP) Rezeptor. Studien haben gezeigt, dass durch Aimovig die Anzahl der monatlichen Migränetage reduziert werden kann. Als häufigste Nebenwirkungen zeigten sich Reaktionen an der Injektionsstelle und Verstopfung.
Der Ausschuss für Humanarzneimittel der Europäischen Arzneimittelagentur EMA hat nun auch den Indikationstext publiziert. Danach ist Aimovig indiziert für die Vorbeugung von Migräne bei Erwachsenen, welche mindestens 4 Migränetage pro Monat aufweisen. Das Medikament wird daher sowohl für die Vorbeugung der episodischen als auch der chronischen Migräne angewendet werden können.
Die Europäische Arzneimittelagentur EMA hat empfohlen, dass Aimovig durch Ärzte verordnet werden kann, die in der Diagnose und Behandlung der Migräne spezialisiert sind. Weitere Einzelheiten zur Verordnung werden in allen europäischen Sprachen publiziert werden, wenn die europäische Kommission die Zulassung ausgesprochen hat.
Im nächsten Schritt hatte die Europäische Kommission die Empfehlung der Europäischen Arzneimittelagentur EMA zu bewerten. Dies ist jetzt erfolgt. Sie gilt für alle 28 Mitgliedsstaaten der Europäischen Union einschließlich Island, Norwegen und Lichtenstein gelten. Danach wird das Medikament voraussichtlich im August/September 2018 auch in Deutschland erhältlich sein. Die Herstellerfirma hat in den USA ein Patienten-Zugangsprogram geschaffen. Dies sieht vor, dass Patienten für zwei Monate das Medikament kostenfrei erhalten können oder die Zuzahlung auf 5 $ pro Monat begrenzt wird.
Zusammenfassung der EMA-Empfehlung zu Erenumab
US-Fachinformation
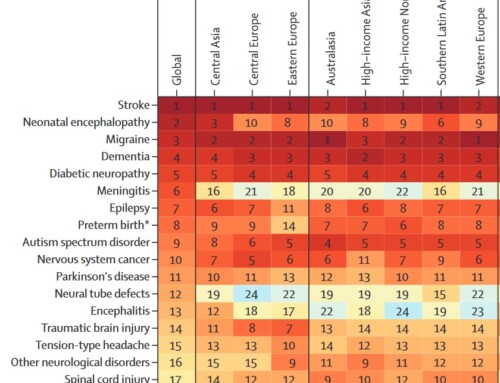
Die Abbildungen zeigen die Zusammenfassungen der Ergebnisse zum klinischen Studienprogramm zu Erenumab, auf denen die Zulassung beruht. Insgesamt nahmen über 3000 Migränepatienten in den klinischen Studien teil. Das Langzeitprogramm umfasst aktuell über 5 Jahre Daten zur Sicherheit und Verträglichkeit. Das Sicherheitsprofil zeigte sich in diesem Zeitraum vergleichbar mit dem einer Placebobehandlung.









Ich hoffe das auch Cluster Patienten davon profitieren können, das wäre ein Traum :)
Endlich
Ich hoffe so sehr das es hilft. Habe zurzeit 15 Migränetage im Monat Stärke 8 bis 10, und wirklich schon alles in meiner Migränekarriere probiert.
Das macht Hoffnung.
Ein sehr wichtiger Schritt für uns Migräniker!!
Auf die Zukunft bin ich sehr gespannt.
Olaf Biewald